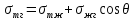13.3. Природа адсорбционного взаимодействия
Величина адсорбции – функция природы адсорбента и адсорбата и зависит от силы взаимодействия между ними. При адсорбции взаимодействуют молекулы, принадлежащие разным фазам, а на границе раздела фаз неизбежно существует асимметрия сил взаимодействия. Кроме того, молекулы адсорбата взаимодействуют не с единичной молекулой адсорбента, а с их совокупностью. Благодаря этому силы взаимодействия в зависимости от их природы могут либо возрастать, либо ослабевать.
Адсорбцию делят на физическую и химическую (хемосорбцию). Как правило, физическая адсорбция обусловлена межмолекулярными (ван-дер-ваальсовыми) силами. В простейшем случае взаимодействие неспецифично, т.е. речь идет об универсальных, дисперсионных силах. Молекулы на поверхности не теряют своей индивидуальности.
Дисперсионное взаимодействие не зависит от температуры. Важным свойством дисперсионных сил является их аддитивность; сила взаимодействия между двумя молекулами не зависит от присутствия других молекул. Аддитивность проявляется в том, что суммируются силы взаимодействия молекул адсорбата со всеми близлежащими атомами поверхности адсорбента. Поэтому при адсорбции пористыми адсорбентами вклад дисперсионных сил в общее взаимодействие оказывается существенно бóльшим. При адсорбции неполярных веществ на полярном адсорбенте (ионный кристалл) к дисперсионным силам притяжения добавляются индукционные силы притяжения диполя, индуцированного электростатическим полем адсорбента. Индукционное притяжение возникает и при адсорбции полярных молекул на неполярном адсорбенте.
Адсорбция полярных молекул на полярном адсорбенте вызывает ориентационное кулоновское взаимодействие диполя адсорбата с электростатическим полем адсорбента. Энергия индукционных, ориентационных и дисперсионных сил при парном взаимодействии обратно пропорциональна шестой степени расстояния между центрами взаимодействующих атомов. Однако ориентационные и индукционные взаимодействия, будучи электростатическими, не являются аддитивными. Так, появление третьей молекулы в поле взаимодействия двух других изменяет ориентацию молекулы и ослабляет эти взаимодействия. Поэтому энергия взаимодействия молекулы адсорбата с поверхностью адсорбента может оказаться меньше, чем энергия ее взаимодействия с одним центром на поверхности. При адсорбции пористыми адсорбентами индукционное и ориентационное взаимодействия вносят меньший вклад. Поэтому наибольшую роль чаще всего играет дисперсионное взаимодействие. Для неполярных или слабополярных молекул его вклад может быть стопроцентным.
Неспецифический характер взаимодействий, вызывающих физическую адсорбцию, определяет и основные признаки этого явления. Равновесие при физической адсорбции устанавливается быстро и обратимо. Теплота физической адсорбции превышает теплоту конденсации обычно не более чем на ~20 кДж/моль.
Химическая адсорбция имеет место, когда молекулы адсорбата вступают в химическое взаимодействие с поверхностью адсорбента с образованием поверхностных химических соединений, но без образования новой объемной фазы. Она гораздо более избирательна и чувствительна к химической природе адсорбата и адсорбента. Теплоты хемосорбции обычно велики (100‑200 кДжмоль).
Хемосорбция может протекать довольно медленно, со скоростью, определяемой наличием некоторого активационного барьера. Поэтому ее часто называют «активированная адсорбция». При низких температурах скорость хемосорбции обычно мала. Хемосорбция, как правило, необратима.
Существует большое многообразие форм адсорбции, переходных между физической и химической адсорбцией. Так, например, широко распространенным видом такого переходного взаимодействия является образование водородной связи при адсорбции. Это характерно для адсорбентов, содержащих на поверхности гидроксильные группы (силикагель, алюмогель и др.). Для этого пограничного типа адсорбции теплота составляет обычно 20-40 кДж/моль.
В связи с разнообразием адсорбционных сил единая теория адсорбции, позволяющая на основе предположений о механизме процесса составить общее математическое описание, пока отсутствует.
Источник
Природа адсорбционных сил. Уравнение Леннард-Джонса.
Смачивание. Краевой угол и теплота смачивания. Уравнение Юнга. Влияние пав на смачивание.
смачиванием – это совокупность поверхностных явлений, происходящих на границе раздела трех контактирующих фаз, т.е. на линии трехфазного контакта. Оно зависит от взаимодействия молекул внутри каждой из фаз и между фазами и сопровождается убылью свободной энергии. При смачивании рассматриваются системы жидкость — газ — твердое тело или жидкость — жидкость — твердое тело. Когда конкурируют две жидкости, то смачивание является избирательным. В зависимости от соотношения интенсивности молекулярных сил, действующих между молекулами жидкости и твердым телом, капля жидкости образует с поверхностью твердого тела определенный равновесный угол Ѳ, называемый краевым углом, который является характеристикой смачивания. Этот угол называется также контактным углом, или углом смачивания. Он образован твердой поверхностью и касательной в точке соприкосновения трех фаз и отсчитывается в сторону более плотной фазы. Установившееся равновесие является как механическим, так и термодинамическим. 

Источник
Адсорбция
Адсорбция является универсальным методом, позволяющим практически полностью извлечь примесь из газовой или жидкой среды. В химической промышленности, в частности в ТНВ, адсорбционный метод широко используется для гладкой очистки и осушки технологических потоков, улучшения качества сырья и продуктов и является одним из методов защиты окружающей среды.
Адсорбция – это концентрирование веществ на поверхности или в объеме твердого тела. В процессе адсорбции участвуют как минимум два компонента. Твердое вещество, на поверхности или в объеме которого происходит концентрирование поглощаемого вещества, называется адсорбентом. Поглощаемое вещество, находящееся в газовой или жидкой фазе называется адсорбтивом, а после того, как оно перешло в адсорбированное состояние – адсорбатом. Любое твердое вещество обладает поверхностью, и следовательно, потенциально является адсорбентом. Однако, в технике используют твердые адсорбенты с развитой внутренней поверхностью. Развитие внутренней поверхности в твердом теле достигается путем создания специальных условий в процессе его синтеза или в результате дополнительной обработки.
С термодинамической точки зрения адсорбция проявляется с уменьшением свободной энергии Гиббса (G). Как и все процессы, сопровождающие уменьшением энергии Гиббса, адсорбция является самопроизвольным процессом. Переход вещества из газовой или жидкой фазы в адсорбированное состояние связан с потерей по меньшей мере одной степени свободы, (трехмерная объемная газовая или жидкая фаза двухмерная поверхностная фаза), что ведет к уменьшению энтропии системы (S). Поскольку энтальпия (Н) связана с энергией Гиббса и энтропией уравнением Н = G + TS, то в процессе адсорбции она убывает, и следовательно, адсорбция – процесс экзотермический.
Адсорбционные явления делят на два основных типа: физическую адсорбцию и хемосорбцию (сорбцию, основанную на силах химического взаимодействия). Физическая адсорбция вызывается силами молекулярного взаимодействия: дисперсионными и электростатическими. Дисперсионные силы вносят основной вклад в энергию взаимодействия молекул. Так, молекулы любого адсорбтива обладают флуктуирующими диполями и квадруполями, вызывающими мгновенные отклонения распределения электронной плотности от среднего распределения. При сближении молекул адсорбтива с атомами или молекулами адсорбента движение флуктуирующих диполей приобретает систематический и строго упорядоченный характер, что приводит к возникновению притяжения между ними. В ряде случаев дисперсионные силы усиливаются электростатическими силами – ориентационными и индукционными. Ориентационные силы возникают при взаимодействии полярных молекул с поверхностью, содержащей, электростатические заряды (ионы, диполи), а индукционные – вызываются изменением электронной структуры молекул адсорбтива и адсорбента под действием друг друга.
В отличие от физической адсорбции, при хемосорбции не сохраняется индивидуальность адсорбтива и адсорбента. При сближении молекул адсорбтива с поверхностью адсорбента происходит перераспределение электронов взаимодействующих компонентов с образованием химической связи. Если физическую адсорбцию можно сравниь с конденсацией, то хемосорбция рассматривается как химический процесс, протекающий на поверхности раздела фаз.
Физическую адсорбцию и хемосорбцию можно отличить на основании численного значения теплоты адсорбции. Теплота адсорбции компонентов промышленных газов соизмерима с теплотой их конденсации и не превышает 85-125 кДж/моль. Теплота хемосорбции одного моля вещества достигает нескольких сотен кДж. Хемосорбция, как правило, протекает с небольшой скоростью, это обстоятельство часто используется для ее распознания. Кроме того, хемосорбция может протекать при высоких температурах, когда физическая адсорбция пренебрежимо мала. При хемоморбции характерным является резкое, скачкообразное изменение поглотительной способности по извлекаемому компоненту при переходе от адсорбента одной химической природы к адсорбенту другой природы. При хемосорбции адсорбированные молекулы не могут перемещаться по поверхности адсорбента, их положение фиксировано, и такая адсорбция называется локализованной. Физическая адсорбция может быть как локализованной, так и не локализованной. Обычно, при повышении температуры молекулы приобретают подвижность и характер процесса изменяется: локализованная адсорбция переходит в нелокализованную.
Источник