Оглавление
Алюми́ний — элемент 13-й группы периодической таблицы химических элементов (поустаревшей классификации — элемент главной подгруппы III группы), третьего периода, сатомным номером 13. Обозначается символом Al (лат. Aluminium). Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния).
Простое вещество алюминий (CAS-номер: 7429-90-5) — лёгкий, парамагнитный металл серебристо — белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия.
- Металл серебристо-белого цвета, лёгкий
- плотность — 2,7 г/см³
- температура плавления у технического алюминия — 658 °C, у алюминия высокой чистоты — 660 °C
- удельная теплота плавления— 390 кДж/кг
- температура кипения — 2500 °C
- удельная теплота испарения— 10,53 МДж/кг
- временное сопротивление литого алюминия — 10-12 кг/мм², деформируемого — 18-25 кг/мм², сплавов — 38-42 кг/мм²
- Твёрдостьпо Бринеллю— 24…32 кгс/мм²
- высокая пластичность: у технического — 35 %, у чистого — 50 %, прокатывается в тонкий лист и даже фольгу
- Модуль Юнга— 70 ГПа
- Алюминий обладает высокой электропроводностью(37·10 6 См/м) и теплопроводностью(203,5 Вт/(м·К)), 65 % от электропроводностимеди, обладает высокой светоотражательной способностью.
- Слабый парамагнетик.
- Температурный коэффициент линейного расширения 24,58·10 −6 К −1 (20…200 °C).
- Удельное сопротивление 0,0262..0,0295 Ом·мм²/м
- Температурный коэффициент электрического сопротивления 4,3·10 −3 K −1 . Алюминий переходит в сверхпроводящее состояние при температуре 1,2 Кельвина.
Распространённость
По распространённости в земной коре Земли занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Массовая концентрация алюминия в земной коре по данным различных исследователей оценивается от 7,45 до 8,14 %
Природные соединения алюминия
- Бокситы — Al2O3 · H2O (с примесями SiO2, Fe2O3, CaCO3)
- Нефелины — KNa3[AlSiO4]4
- Алуниты — (Na,K)2SO4·Al2(SO4)3·4Al(OH)3
- Глинозёмы (смеси каолинов с песком SiO2, известняком CaCO3, магнезитом MgCO3)
- Корунд (сапфир, рубин, наждак) — Al2O3
- Полевые шпаты — (K,Na)2O·Al2O3·6SiO2, Ca[Al2Si2O8]
- Каолинит — Al2O3·2SiO2 · 2H2O
- Берилл (изумруд, аквамарин) — 3ВеО · Al2О3 · 6SiO2
- Хризоберилл (александрит) — BeAl2O4.
Источник
Алюминий
Алюминий является самым распространенным металлом в земной коре. Свойства алюминия позволяют активно применять в составе металлоконструкций: он легкий, мягкий, поддается штамповке, обладает высокой антикоррозийной устойчивостью.
Для алюминия характерна высокая химическая активность, отличается также высокой электро- и теплопроводностью.
Основное и возбужденное состояние
При переходе атома алюминия в возбужденное состояние 2 электрона s-подуровня распариваются, и один электрон переходит на p-подуровень.
Природные соединения
- Al2O3 — корунд
- 3BeO*Al2O3*6SiO2 — берилл (аквамарин — примесь Fe и изумруд — примесь Cr2O3)
- Al2O3*Cr2O3 — красный рубин
- Al2O3 с примесью Fe +2 /Fe +3 /Ti
- Al2O3*H2O — боксит
Получение
Алюминий получают путем электролиза расплава Al2O3 в криолите (Na3[AlF6]). Галлий, индий и таллий получают схожим образом — методом электролиза их оксидов и солей.
Химические свойства
При комнатной температуре реагирует с галогенами (кроме фтора) и кислородом, покрываясь при этом оксидной пленкой.
Al + Br2 → AlBr3 (бромид алюминия)
При нагревании алюминий вступает в реакции с фтором, серой, азотом и углеродом.
Al + F2 → (t) AlF3 (фторид алюминия)
Al + S → (t) Al2S3 (сульфид алюминия)
Al + N2 → (t) AlN (нитрид алюминия)
Al + C → (t) Al4C3 (карбид алюминия)
Алюминий проявляет амфотерные свойства (греч. ἀμφότεροι — двойственный), вступает в реакции как с кислотами, так и с основаниями.
Al + NaOH + H2O → Na[Al(OH)4] + H2↑ (тетрагидроксоалюминат натрия; поскольку алюминий дан в чистом виде — выделяется водород)
При прокаливании комплексные соли не образуются, так вода испаряется — вместо них образуются (в рамках ЕГЭ) средние соли — алюминаты (академически — сложные окиселы):
При комнатной температуре не идет из-за образования оксидной пленки — Al2O3 — на воздухе. Если разрушить оксидную пленку нагреванием раствора щелочи или амальгамированием (покрытием металла слоем ртути) — реакция идет.
Алюминотермия (лат. Aluminium + греч. therme — тепло) — способ получения металлов и неметаллов, заключающийся в восстановлении их оксидов алюминием. Температуры при этом процессе могут достигать 2400°C.
С помощью алюминотермии получают Fe, Cr, Mn, Ca, Ti, V, W.
Оксид алюминия
Оксид алюминия получают в ходе взаимодействия с кислородом — на воздухе алюминий покрывается оксидной пленкой. При нагревании гидроксид алюминия, как нерастворимое основание, легко разлагается на оксид и воду.
Проявляет амфотерные свойства: реагирует и с кислотами, и с основаниями.
Al2O3 + NaOH + H2O → Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Гидроксид алюминия
Гидроксид алюминия получают в ходе реакций обмена между растворимыми солями алюминия и щелочами. В результате гидролиза солей алюминия часто выпадает белый осадок — гидроксид алюминия.
Проявляет амфотерные свойства. Реагирует и с кислотами, и с основаниями. Вследствие нерастворимости гидроксид алюминия не реагирует с солями.
Al(OH)3 + LiOH → Li[Al(OH)4] (при избытке щелочи будет верным написание — Li3[Al(OH)6] — гексагидроксоалюминат лития)
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Алюминий
Источник
Химические свойства алюминия
Одним из распространённых элементов планеты является алюминий. Физические и химические свойства алюминия применяются в промышленности. Все, что необходимо знать, про этот металл вы найдете в нашей статье.
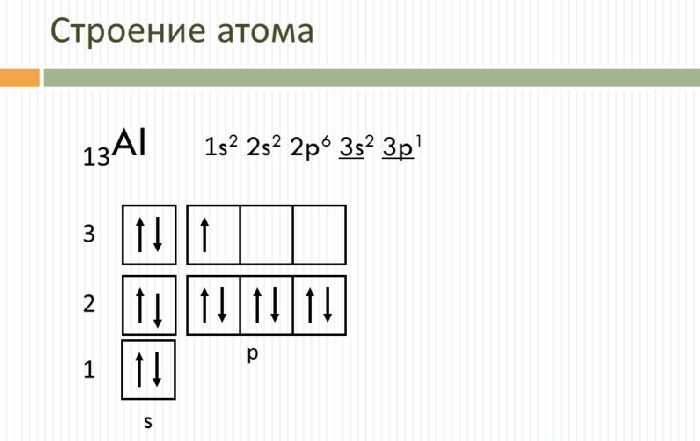
Строение атома
Алюминий – это 13 элемент периодической таблицы. Он находится в третьем периоде, III группе, главной подгруппе.
Свойства и применение алюминия связаны с его электронным строением. Атом алюминия имеет положительно заряженное ядро (+13) и 13 отрицательно заряженных электронов, располагающихся на трёх энергетических уровнях. Электронная конфигурация атома – 1s 2 2s 2 2p 6 3s 2 3p 1 .
На внешнем энергетическом уровне находится три электрона, которые определяют постоянную валентность III. В реакциях с веществами алюминий переходит в возбуждённое состояние и способен отдавать все три электрона, образуя ковалентные связи. Как и другие активные металлы, алюминий является мощным восстановителем.
Алюминий – амфотерный металл, образующий амфотерные оксиды и гидроксиды. В зависимости от условий соединения проявляют кислотные или основные свойства.
Физическое описание
- лёгкостью (плотность 2,7 г/см 3 );
- серебристо-серым цветом;
- высокой электропроводностью;
- ковкостью;
- пластичностью;
- температурой плавления – 658°C;
- температурой кипения – 2518,8°C.
Из металла делают жестяные ёмкости, фольгу, проволоку, сплавы. Алюминий используют при изготовлении микросхем, зеркал, композитных материалов.
Алюминий – парамагнетик. Металл притягивается магнитом только в присутствии магнитного поля.
Химические свойства
На воздухе алюминий быстро окисляется, покрываясь оксидной плёнкой. Она защищает металл от коррозии, а также препятствует взаимодействию с концентрированными кислотами (азотной, серной).
При обычных условиях реакции с алюминием возможны только после удаления оксидной плёнки. Большинство реакций протекают при высоких температурах.
Основные химические свойства элемента описаны в таблице.
Горит при высоких температурах с выделением тепла
Взаимодействует с серой при температуре выше 200°С, с фосфором – при 500°С, с азотом – при 800°С, с углеродом – при 2000°С
Реагирует при обычных условиях, с йодом – при нагревании в присутствии катализатора (воды)
Реагирует с разбавленными кислотами при обычных условиях, с концентрированными – при нагревании
Реагирует с водными растворами щелочей и при сплавлении
Вытесняет менее активные металлы
Алюминий не реагирует непосредственно с водородом. Реакция с водой возможна после снятия оксидной плёнки.
Что мы узнали?
Алюминий – амфотерный активный металл с постоянной валентностью. Обладает небольшой плотностью, высокой электропроводностью, пластичностью. Притягивается магнитом только в присутствии магнитного поля. Алюминий реагирует с кислородом, образуя защитную плёнку, которая препятствует реакциям с водой, концентрированными азотной и серной кислотами. При нагревании взаимодействует с неметаллами и концентрированными кислотами, при обычных условиях – с галогенами и разбавленными кислотами. В оксидах вытесняет менее активные металлы. Не реагирует с водородом.
Источник