1. Алюминий: общая характеристика, строение; свойства и получение
По распространённости в земной коре алюминий находится на третьем месте после кислорода и кремния, а среди металлов — на первом.
- боксит, состав которого можно примерно выразить формулой Al 2 O 3 ⋅ xH 2 O ⋅ SiO 2 ⋅ 2 H 2 O ,
- нефелин ( Na , K ) O ⋅ Al 2 O 3 ⋅ xH 2 O ⋅ 2 H 2 O 2 ,
- каолинит Al 2 O 3 ⋅ xH 2 O ⋅ SiO 2 ⋅ 2 H 2 O .
Каолинит — образец многочисленных алюмосиликатов , включающих преимущественно атомы кремния и кислорода, которые очень широко распространены в природе.
В свободном состоянии алюминий — светлый блестящий металл, лёгкий , относительно мягкий, легкоплавкий, имеет высокую тепло- и электропроводность.
Алюминий является химически активным металлом, однако при обычных условиях он устойчив на воздухе и сохраняет свой металлический блеск длительное время. Это объясняется тем, что поверхность алюминия покрыта тонкой, невидимой глазу, прозрачной, но плотной плёнкой оксида алюминия, которая препятствует взаимодействию алюминия с компонентами атмосферы (парами воды и кислородом).
Свойства алюминия обусловили его широкое применение и необходимость получения алюминия в свободном виде.
В лабораторных условиях небольшое количество алюминия можно получить путём восстановления хлорида алюминия калием при высокой температуре:
В промышленных условиях алюминий получают из бокситов. При нагревании бокситов образуется оксид алюминия. Восстановить алюминий из оксида с помощью традиционных восстановителей практически невозможно, поэтому его получают методом электролиза .
Источник
Химические свойства алюминия
Одним из распространённых элементов планеты является алюминий. Физические и химические свойства алюминия применяются в промышленности. Все, что необходимо знать, про этот металл вы найдете в нашей статье.
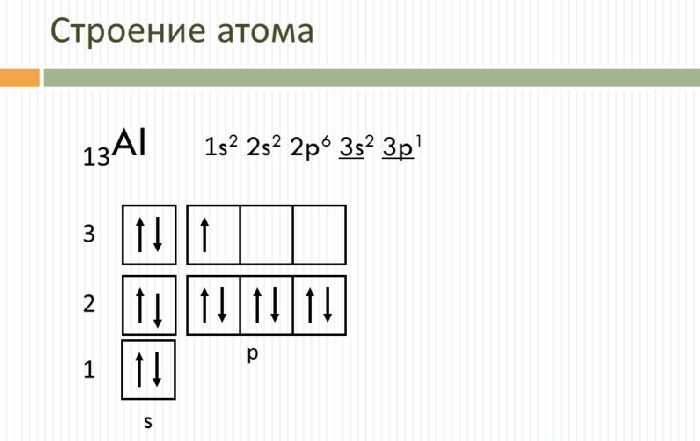
Строение атома
Алюминий – это 13 элемент периодической таблицы. Он находится в третьем периоде, III группе, главной подгруппе.
Свойства и применение алюминия связаны с его электронным строением. Атом алюминия имеет положительно заряженное ядро (+13) и 13 отрицательно заряженных электронов, располагающихся на трёх энергетических уровнях. Электронная конфигурация атома – 1s 2 2s 2 2p 6 3s 2 3p 1 .
На внешнем энергетическом уровне находится три электрона, которые определяют постоянную валентность III. В реакциях с веществами алюминий переходит в возбуждённое состояние и способен отдавать все три электрона, образуя ковалентные связи. Как и другие активные металлы, алюминий является мощным восстановителем.
Алюминий – амфотерный металл, образующий амфотерные оксиды и гидроксиды. В зависимости от условий соединения проявляют кислотные или основные свойства.
Физическое описание
- лёгкостью (плотность 2,7 г/см 3 );
- серебристо-серым цветом;
- высокой электропроводностью;
- ковкостью;
- пластичностью;
- температурой плавления – 658°C;
- температурой кипения – 2518,8°C.
Из металла делают жестяные ёмкости, фольгу, проволоку, сплавы. Алюминий используют при изготовлении микросхем, зеркал, композитных материалов.
Алюминий – парамагнетик. Металл притягивается магнитом только в присутствии магнитного поля.
Химические свойства
На воздухе алюминий быстро окисляется, покрываясь оксидной плёнкой. Она защищает металл от коррозии, а также препятствует взаимодействию с концентрированными кислотами (азотной, серной).
При обычных условиях реакции с алюминием возможны только после удаления оксидной плёнки. Большинство реакций протекают при высоких температурах.
Основные химические свойства элемента описаны в таблице.
Горит при высоких температурах с выделением тепла
Взаимодействует с серой при температуре выше 200°С, с фосфором – при 500°С, с азотом – при 800°С, с углеродом – при 2000°С
Реагирует при обычных условиях, с йодом – при нагревании в присутствии катализатора (воды)
Реагирует с разбавленными кислотами при обычных условиях, с концентрированными – при нагревании
Реагирует с водными растворами щелочей и при сплавлении
Вытесняет менее активные металлы
Алюминий не реагирует непосредственно с водородом. Реакция с водой возможна после снятия оксидной плёнки.
Что мы узнали?
Алюминий – амфотерный активный металл с постоянной валентностью. Обладает небольшой плотностью, высокой электропроводностью, пластичностью. Притягивается магнитом только в присутствии магнитного поля. Алюминий реагирует с кислородом, образуя защитную плёнку, которая препятствует реакциям с водой, концентрированными азотной и серной кислотами. При нагревании взаимодействует с неметаллами и концентрированными кислотами, при обычных условиях – с галогенами и разбавленными кислотами. В оксидах вытесняет менее активные металлы. Не реагирует с водородом.
Источник