Аминокислоты
А вы знаете, что многие ученые называют жизнь на земле «белковой»? Основу белка составляют аминокислоты. А как они появились на Земле?
Белки — это макромолекулы, имеющие большую молекулярную ( до 1,5 млн у.е.) массу. Все белки являются полимерами нерегулярного строения, состоящими из отдельных мономеров — аминокислот, определяющихся генетическим кодом.
Есть такая гипотеза, что в самом начале на Земле не было всех тех органических соединений, которые мы наблюдаем теперь. И в то далекое-предалекое время наша планета постоянно подвергалась бомбардировке метеоритами и кометами. И эти самые метеориты содержали в себе органические соединения, в том числе и аминокислоты. Получается, что жизнь на Землю принесли извне…
У любой теории есть много как сторонников, так и противников. В научном мире жаркие споры по этой теме до сих пор не угасают, наша задача — разобраться что такое аминокислоты и белки какую роль они играют в нашем мире.
Аминокислота — вещество, имеющее двойственную природу:
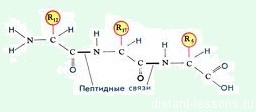
Из-за наличия аминогруппы и карбоксильной группы аминокислоты амфотерны — проявляют и основные и кислотные свойства и могут соединяться между собой. Такая связь называется пептидной.
Белков на Земле огромное количество. Это обязательная часть химического состава клетки. Как получилось, что природа имеет столько вариантов?
- Аминокислоты в белке могут находиться в разной последовательности. Именно разные сочетания аминокислот в белковой цепи дает такую вариативность.
В природе известно 20 видов аминокислот.
Откуда они берутся в природе? Обычно они получаются при гидролизе белков и затем, в ходе обмена веществ, опять образуют белки.
Заменимые аминокислоты наш организм может синтезировать сам, но при этом обеспечивается только минимум потребностей организма.
Незаменимые аминокислоты — те, которые организм потребляет извне — с белковой пищей или образуются из других аминокислот.
Интересно то, что растения могут синтезировать ВСЕ аминокислоты! Что бы мы без них делали? И кислород они нам для дыхания поставляют, и аминокислотами у них запастись можно… одним словом, Продуценты!
Для формата ЕГЭ не нужно знать наизусть все 20 аминокислот и их формулы, но надо понимать их строение и функции в организме, ведь аминокислоты — «кирпичики» белков, а жизнь у нас именно белковая! 🙂
Белки
они же полипептиды, они же протеины
Ф.Энгельс биологом не был, но дал такое определение жизни:
Жизнь есть способ существования белковых тел, существенным моментом которого является постоянный обмен веществ с окружающей их внешней природой, причем с прекращением этого обмена веществ прекращается и жизнь, что приводит к разложению белка
Конечно, это определение не научное и не затрагивает очень многие признаки живых систем, но определяет один самый важный момент —
жизнь на земле белковая
Строение и функции белков
Белки — полимеры, мономерами которых являются аминокислоты. В составе белков всего 20 аминокислот, а вот комбинаций этих аминокислот может быть очень много! За счет этого достигается разнообразие. Поэтому белков в природе огромное количество!
Белковый состав так и записывается — последовательностью аминокислот, которые обозначаются тремя буквами:
То, что показано на рисунке — последовательность аминокислот — это целая длинная большая молекула (то, что приведено здесь — это очень маленький белок, обычно такие молекулы на порядок длиннее).
В теме про аминокислоты мы уже рассмотрели механизм образования такого полимера — полипептида.
- простые — состоят только из аминокислот;
- сложные — кроме аминокислот содержат вещества небелковой природы.
Первичная структура (конформация) белка
— это именно эта последовательность — то, какие аминокислоты и в какой последовательности они соединены ковалентными связями.
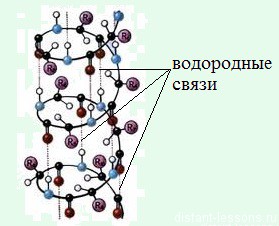
Вторичная структура белка
Это спираль, которая образуется уже за счет межмолекулярных — водородных связей.
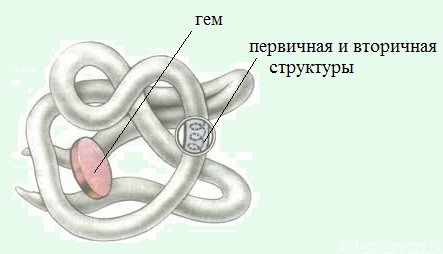
Третичная структура белка
Эта структура образована свернутыми спиралями — такое образование называется глобула.
Четвертичная структура белка
это совместное объединение нескольких схожих по строению третичных белковых структур (глобул или субъединиц) в единую молекулу с приобретением ею природных свойств.
Сами глобулы в этой структуре называют протомерами, а само четвертичное образование — мультимером.
Белки довольно легко подвергаются разрушению. Сначала «ломается» четвертичная, потом третичная, потом уже вторичная структура. Разрушить первичную структуру сложнее. Это уже, скорее, химическое взаимодействие.
Разрушение структур белка называется денатурацией. Свойства белка при этом теряются.
Самые известные денатуранты -температура (нагревание), спирт, кислоты и щелочи.
Простой и повседневный пример денатурации — яичница! 🙂
Ренатурация — обратный процесс — восстановление разрушенной структуры белка.
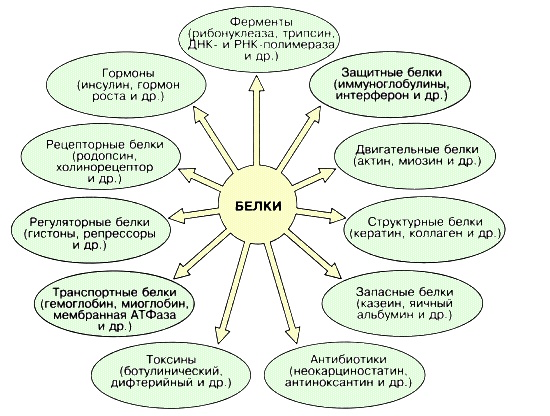
Функции белков
- структурная — белок является обязательным компонентом любой мембраны, любого хряща…
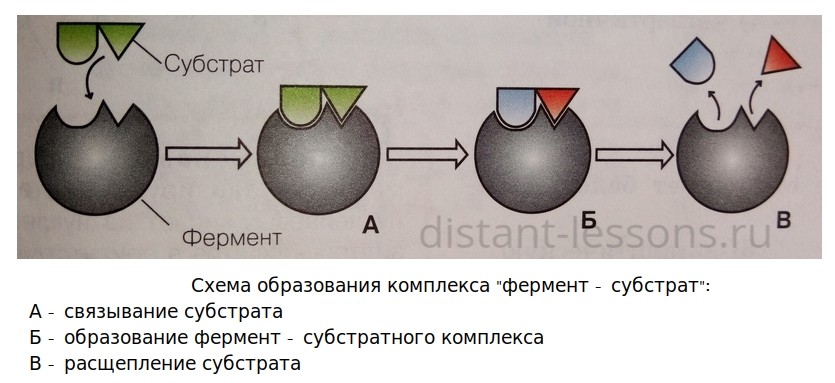
- почти все ферменты имеют белковую природу. Ферменты=биокатализаторы. На каждую реакцию есть свой фермент.
Функций у белков очень много… то, что перечислено выше — только самые основные.

- у разных видов есть одинаковые белки, выполняющие определенные функции (например, у собаки и человека за регуляцию сахара в крови отвечает гормон инсулин)
- у представителей одного вида белки могут отличаться по строению (например, белки групп крови)
Белки — основа жизни на Земле, и найти какие-либо процессы, проходящие в живом организме без их участия, практически невозможно…
Редко, но все же встречаются в вопросах ЕГЭ такие термины:
Источник
7. Аминокислоты, входящие в состав белков, их строение и свойства. Пептидная связь. Первичная структура белков.
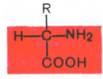
α-Аминокислотыпредставляют собой производные карбоновых кислот, у которых один водородный атом, у α-углерода, замещен на аминогруппу (—NH2).
Аминокислоты будут отличаться друг от друга химической природой радикала R, представляющего группу атомов в молекуле аминокислоты, связанную с α-углеродным атомом и не участвующую в образовании пептидной связи при синтезе белка. Почти все α-амино- и α-карбоксильные группы участвуют в образовании пептидных связейбелковой молекулы, теряя при этом свои специфические для свободных аминокислот кислотно-основные свойства. Поэтому все разнообразие особенностей структуры и функции белковых молекул связано с химической природой и физико-химическими свойствами радикалов аминокислот. Именно благодаря им белки наделены рядом уникальных функций, не свойственных другим биополимерам, и обладают химической индивидуальностью. В состав белков входят 20 природных аминокислот.
Кислотно-основные свойства.Эти свойства аминокислот определяют многие физико-химические и биологические свойства белков. На этих свойствах основаны, кроме того, почти все методы выделения и идентификации аминокислот. Аминокислоты легко растворимы в воде. Они кристаллизуются из нейтральных водных растворов в форме биполярных (амфотерных) ионов, а не в виде недиссоциированных молекул. В связи с этим, они могут проявлять как основные, так и кислотные свойства, что зависит еще от природы входящего в их состав радикала.
Стереохимия аминокислот.Важнейшим свойством аминокислот, освобождающихся в процессе гидролиза природных белков в условиях, исключающих рацемизацию, является их оптическая активность. Это свойство связано с наличием в молекуле всех природных аминокислот (за ислючением глицина) в α-положении асимметрического атома углерода. Стереохимию аминокислот принято оценивать не по оптическому вращению, а исходя из абсолютной конфигурации всех четырех замещающих групп, расположенных вокруг асимметрического атома углерода в вершинах модели тетраэдра. Абсолютную конфигурацию аминокислот принято соотносить стереохимически с соединением, произвольно взятым для сравнения, а именно с глицериновым альдегидом, также содержащим асимметрический атом углерода. Все аминокислоты, образующиеся при гидролизе природных белков в условиях, исключающих рацемизацию, принадлежит к L-ряду. Таким образом, природные аминокислоты имеют пространственное расположение, аналогичное конфигурации L-глицеринового альдегида.
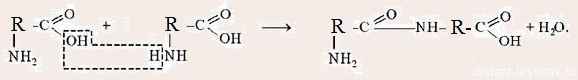
Пептидная связь— вид амидной связи, возникающей при образованиибелковипептидовв результате взаимодействия α-аминогруппы (—NH2) однойаминокислотыс α-карбоксильной группой (—СООН) другой аминокислоты. Из двухаминокислот(1) и (2) образуетсядипептид(цепочка из двух аминокислот) и молекула воды. По этой же схемерибосомагенерирует и более длинные цепочки из аминокислот:полипептидыибелки.
Первичная структура— последовательность аминокислот в полипептидной цепи. Важными особенностями первичной структуры являютсяконсервативные мотивы— сочетания аминокислот, играющих ключевую роль в функциях белка. Консервативные мотивы сохраняются в процессеэволюциивидов, по ним часто удаётся предсказать функцию неизвестного белка. Первичная структура предопределяет все дальнейшие виды организации белковой молекулы.
Источник