Белки
Структура Белков — 3-х мерная структура миоглобина с выделеными α спиралями.
История изучения [ ]
Структура белка [ ]
Схематическое изображение первичной структуры белка. Как видно, различные R-группы аминокислотных остатков образуют ответвления от основной цепи, построенной из одинаковых звеньев.
Молекулы белков представляют собой линейные L-α-аминокислот (которые являются мономерами) и, в некоторых случаях, из модифицированных основных аминокислот (правда аминокислот в научной литературе используются одно- или трёхбуквенные сокращения.
При образовании белка в результате взаимодействия α-аминогруппы (-NH2) одной аминокислоты с α-карбоксильной группой (-СООН) другой аминокислоты образуются информации, содержащейся в гене данного белка. Эта информация представлена в виде поcледовательности нуклеотидов, причем одной аминокислоте соответсвует одна или несколько последовательностей из трех нуклеотидов — так называемых кодонов. То, какая аминокислота соответствует данному кодону в мРНК определяется генетическим кодом, который может несколько отличаться у разных организмов.
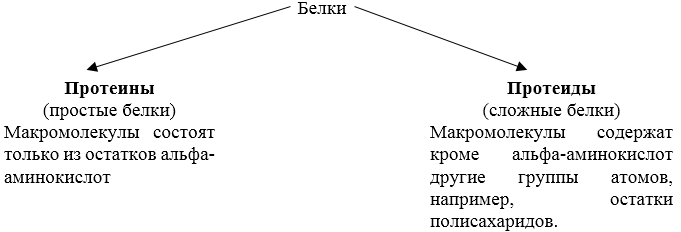
Гомологичные белки (выполняющие одну функцию и предположительно имеющие общее эволюционного происхождение, например, Простые и сложные белки [ ]
Основные статьи: эукариот, например, имеют полисахаридные цепи, которые помогают белку принимать нужную конформацию и придают дополнительную стабильность. Уровни структуры белка [ ]
Структура Белков — Примеры изображения трёхмерной структуры биологической единицы белка. Слева — «палочковая» модель, с изображением всех атомов и связей между ними. Цветами показаны элементы. В середине изображены структурные мотивы, α-спирали и β-листы. Справа изображены атомы в соответсвии с их Ван-Дер-Ваальсовыми радиусами.
Выделяют четыре уровня структуры белка:
- Первичная структура — последовательность глутаминовой кислоты, лейцин могут стерически мешать образованию спирали, 3 10 > -спирали;
- β-листы (складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между разными цепями, а не внутри одной, как имеет место в α-спирали. Эти цепи обычно направлены N-концами в разные стороны (антипараллельная ориентация). Для образования листов важны небольшие размеры R-групп аминокислот, преобладают обычно атомов.
- Cубъединичную ( Свойства [ ]
Денатурация [ ]
Так как и другие биологические макромолекулы ( живых организмов, и участвуют в каждом внутреннем процессе клетки. Они являются обязательными ферментов (также белковой природы) на свободные аминокислоты, которые потом можно использовать для синтезирования нужных протеинов. Белки осуществляют обмен веществ и энергетические превращения. Белки входят в состав клеточных структур — животных. Белки входят в состав клеточных мембран. Также белки формируют цитоскелет, обеспечивающий поддержание формы клетки и участвующий во внутриклеточном транспорте. Каталитическая функция Ферменты ( катализаторами химических реакций в организме. Известно несколько тысяч ферментов, среди них, наример, вирусы или чужеродные белки, крови. Регуляторная функция Полипептидные (белковые) крови и кислород из легких к остальным тканям и углекислый газ от тканей к легким. Энергетическая функция Как запасной источник энергии. При полном расщеплении 1 г белка выделяется 17,6кДж энергии. Запасная (резервная) функция белков К таким белкам относятся так называемые резервные белки, являющиеся источниками питания для развития плода; белки метаболизма. Рецепторная функция В мембрану клетки встроены белки, способные изменять свою третичную структуру в ответ на действие факторов внешней среды. Так происходит прием сигналов из внешней среды и передача информации в клетку. Моторная и сократительные функции Целый класс См. также [ ]
| Это заготовка статьи по биохимии. Вы можете помочь проекту, исправив и дополнив её. |
| |