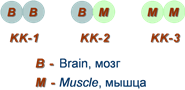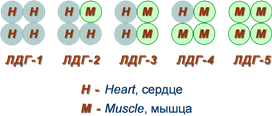2. Ферменты
Ферменты, или энзимы — вещества белковой природы, обладающие каталитической активностью. Термин «энзим» — от греч. en zyme- в дрожжах, «фермент» — от лат. fermentatio — брожение.
Учение о ферментах выделено в самостоятельную науку энзимологию.
Хотя уже осуществлен лабораторный синтез ряда ферментов — рибонуклеазы, лизоцима, единственный способ получения ферментов — это выделение их из биологических объектов.
2.1. Химическая природа ферментов
Доказательства белковой природы ферментов:
1. Ферменты при гидролизе распадаются на аминокислоты.
2. Под действием кипячения и др. факторов ферменты подвергаются денатурации и теряют каталитическую активность.
3. Осуществлено выделение ферментов в форме кристаллов белка.
4. Ферменты оказывают высокоспецифическое действие.
Прямым доказательством белковой природы ферментов является лабораторный синтез первого фермента – рибонуклеазы.
Выделяют простые ферменты, состоящие только из полипептидной цепи: пепсин, трипсин, уреаза, рибонуклеаза, фосфатаза и др.
Большинство природных ферментов — сложные белки. Их небелковые компоненты называются кофакторами и необходимы для выполнения ферментом его каталитической роли. Кофакторами ферментов являются витамины или соединения, построенные с их участием (коэнзим А, НАД + , ФАД); фосфорные эфиры некоторых моносахаридов, ионы металов.
Кофермент — небелковый фактор, который легко отделяется от белковой части — апофермента при диссоциации.
Простетическая группа – ковалентно связанный с белковой цепью небелковый компонент, который не отделяется при выделении и очистке фермента.
Весь фермент вместе с простетической группой назыывают холоферментом. Только объединение апофермента и кофермента обеспечивает активность холофермента.
Субстрат – вещество, подвергающееся превращениям под действием фермента.
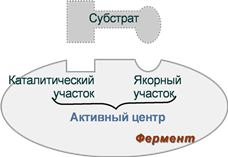
Активный центр — специфический участок на поверхности фермента, связывающийся с молекулой субстрата и непосредственно участвующий в катализе. Активные центры ферментов образуются на уровне третичной структуры. У сложных ферментов в состав активного центра входят также простетические группы. Кофакторы ферментов выполняют роль промежуточных переносчиков атомов или групп.
В активном центре различают два участка. Субстратный (связывающий) центр — участок, отвечающий за присоединение субстрата. Его называют контактной, или «якорной» площадкой фермента. Каталитический центр отвечает за химическое превращение субстрата. В состав каталитического центра большинства ферментов входят такие аминокислоты, как серин, цистеин, гистидин, тирозин, лизин. Субстратный центр может совпадать (или перекрываться) с каталитическим центром.
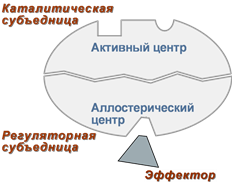
Аллостерический центр — участок молекулы фермента вне его активного центра, который способен связываться с тем или иным веществом (лигандом). В результате изменяется третичная, а часто и четвертичная структура белковой молекулы. Как следствие изменяется конфигурация активного центра и каталитическая активность фермента. Это т. н. аллостерическая регуляция активности ферментов. Ферменты, активность каталитического центра которых подвергается изменению под влиянием аллостерических эффекторов, называют аллостерическими.
Некоторые из ферментов являются полифункциональными, т. е. обладают несколькими энзиматическими активностями, но всего лишь одной полипептидной цепью. Их белковая цепь образует несколько доменов, каждый из которых характеризуется своей каталитической активностью. Например, алкогольдегидрогеназа не только катализирует реакцию окисления спиртов, но также реакции обезвреживания ряда ксенобиотиков.
Изоферменты — это множественные формы фермента, катализирующие одну и ту же реакцию, но отличающиеся друг от друга по физическим и химическим свойствам — сродству к субстрату, активности, электрофоретической подвижности.
Например, фермент лактатдегидрогеназа катализирует обратимое превращение пировиноградной кислоты в молочную. Она состоит из 4 субъединиц и содержит два типа полипептидных цепей: Н- сердечный тип (от англ. heart- сердце) и М — мышечный тип (от англ. muscle- мышца). Этот фермент благодаря различным сочетаниям субъединиц может существовать в 5 формах:
Для каждой ткани в норме характерно свое соотношение форм (изоферментный спектр) ЛДГ. Например, в сердечной мышце преобладает Н4, т.е. ЛДГ1, а в скелетных мышцах и печени – М4 (ЛДГ5). Изучение появления изоферментов ЛДГ в сыворотке крови позволяет судить о месте патологического процесса и о степени поражения органа или ткани.
Особую группу ферментов составляют мультимолекулярные ферментные комплексы. Существование таких комплексов ускоряет химические превращения. Если мультиэнзимный комплекс обслуживает единый, многоступенчатый процесс биохимических превращений, его называют метаболоном. Таковы метаболоны гликолиза, цикла Кребса, дыхательная цепь митохондрий и др.
Источник
Ферменты имеют белковую природу
Давно выяснено, что все ферменты являются белками и обладают всеми свойствами белков. Поэтому, подобно белкам, ферменты делятся на простые и сложные.
Простые ферменты состоят только из аминокислот – например, пепсин , трипсин, лизоцим.
Сложные ферменты ( холоферменты ) имеют в своем составе белковую часть, состоящую из аминокислот – апофермент , и небелковую часть – кофактор . Примером сложных ферментов являются сукцинатдегидрогеназа (содержит ФАД), аминотрансферазы (содержат пиридоксальфосфат), различные пероксидазы (содержат гем), лактатдегидрогеназа (содержит Zn 2+ ), амилаза (содержит Ca 2+ ).
Кофактор, в свою очередь, может называться коферментом (НАД + , НАДФ + , ФМН, ФАД, биотин) или простетической группой (гем, олигосахариды, ионы металлов Fe 2+ , Mg 2+ , Ca 2+ , Zn 2+ ).
Деление на коферменты и простетические группы не всегда однозначно:
• если связь кофактора с белком прочная, то в этом случае говорят о наличии простетической группы,
• но если в качестве кофактора выступает производное витамина – то его называют коферментом, независимо от прочности связи.
Для осуществления катализа необходим полноценный комплекс апобелка и кофактора, по отдельности катализ они осуществить не могут. Кофактор входит в состав активного центра, участвует в связывании субстрата или в его превращении.
Как многие белки, ферменты могут быть мономерами, т.е. состоять из одной субъединицы, и полимерами, состоящими из нескольких субъединиц.
Структурно-функциональная организация ферментов
В составе фермента выделяют области, выполняющие различную функцию:
1. Активный центр – комбинация аминокислотных остатков (обычно 12-16), обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ. Аминокислотные радикалы в активном центре могут находиться в любом сочетании, при этом рядом располагаются аминокислоты, значительно удаленные друг от друга в линейной цепи. В активном центре выделяют два участка:
- якорный (контактный, связывающий) – отвечает за связывание и ориентацию субстрата в активном центре,
- каталитический – непосредственно отвечает за осуществление реакции.
Схема строения ферментов
У ферментов, имеющих в своем составе несколько мономеров, может быть несколько активных центров по числу субъединиц. Также две и более субъединицы могут формировать один активный центр.
У сложных ферментов в активном центре обязательно расположены функциональные группы кофактора. Например, в реакции превращения пировиноградной кислоты (пируват) в молочную кислоту (лактат) сначала к апоферменту лактатдегидрогеназы присоединяется НАД, формируется активный центр, и только потом входит пируват.
Схема формирования сложного фермента
2. Аллостерический центр (allos – чужой) – центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов. Связывание с аллостерическим центром какой-либо молекулы, называемой активатором или ингибитором (или эффектором, модулятором, регулятором), вызывает изменение конфигурации белка-фермента и, как следствие, скорости ферментативной реакции.
Аллостерические ферменты являются полимерными белками, активный и регуляторный центры находятся в разных субъединицах.
Схема строения аллостерического фермента
В качестве такого регулятора может выступать продукт данной или одной из последующих реакций, субстрат реакции или иное вещество (см «Регуляция активности ферментов»).
Изоферменты
Изоферменты – это молекулярные формы одного и того же фермента, возникшие в результате небольших генетических различий в первичной структуре фермента, но катализирующие одну и ту же реакцию. Изоферменты отличаются сродством к субстрату, максимальной скоростью катализируемой реакции, чувствительностью к ингибиторам и активаторам, условиями работы (оптимум pH и температуры).
Как правило, изоферменты имеют четвертичную структуру, т.е. состоят из двух или более субъединиц. Например, димерный фермент креатинкиназа (роль КК) представлен тремя изоферментными формами, составленными из двух типов субъединиц: M (англ. muscle – мышца) и B (англ. brain – мозг). Креатинкиназа-1 (КК-1) состоит из субъединиц типа B и локализуется в головном мозге, креатинкиназа-2 (КК-2) – по одной М- и В-субъединице, наиболее активна в миокарде, креатинкиназа-3 (КК-3) содержит две М-субъединицы, специфична для скелетной мышцы. Определение активности разных изоферментов КК в сыворотке крови имеет клинико-диагностическое значение.
Необходимо понимать, что хотя в головном мозге активность креатинкиназы ВВ составляет все 100%, ее высокая активность обнаружена также в стенке желудка и почках. В скелетных мышцах имеется только креатинкиназа ММ (100%), но довольно высока ее активность также в печени и в сердце. Креатинкиназа МВ в сердце составляет лишь 22% от общей креатинкиназной активности, в большем количестве здесь имеется КК ММ, но зато в других тканях креатинкиназы МВ практически нет.
Изоферменты креатинкиназы
Изоферменты лактатдегидрогеназы
Также существует пять изоферментов лактатдегидрогеназы (роль ЛДГ) – фермента, участвующего в обмене глюкозы. Отличия между ними заключаются в разном соотношении субъединиц Н (англ. heart – сердце) и М (англ. muscle – мышца). Лактатдегидрогеназы типов 1 (Н4) и 2 (H3M1) присутствуют в тканях с аэробным обменом (миокард, мозг, корковый слой почек), обладают высоким сродством к молочной кислоте (лактату) и превращают его в пируват. Изоферменты ЛДГ-4 (H1M3) и ЛДГ-5 (М4) находятся в тканях, склонных к анаэробному обмену (печень, скелетные мышцы, кожа, мозговой слой почек), обладают низким сродством к лактату и катализируют превращение пирувата в лактат. В тканях с промежуточным типом обмена (селезенка, поджелудочная железа, надпочечники, лимфатические узлы) преобладает ЛДГ-3 (H2M2). Определение активности разных изоферментов ЛДГ в сыворотке крови имеет клинико-диагностическое значение.
Еще одним примером изоферментов является группа гексокиназ, которые присоединяют фосфатную группу к моносахаридам гексозам и вовлекают их в реакции клеточного метаболизма. Из четырех изоферментов выделяется гексокиназа IV (глюкокиназа), которая отличается от остальных изоферментов высокой специфичностью к глюкозе, низким сродством к ней и нечувствительностью к ингибированию продуктом реакции.
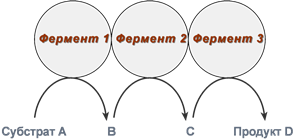
Мультиферментные комплексы
В мультиферментном комплексе несколько ферментов прочно связаны между собой в единый комплекс и осуществляют ряд последовательных реакций, в которых продукт реакции непосредственно передается на следующий фермент и является только его субстратом. Возникает туннельный эффект, т.е. субстрат попадает в созданный ферментами «туннель». В результате промежуточные метаболиты избегают контакта с окружающей средой, снижается время их перехода к следующему активному центру и значительно ускоряется скорость реакции.
Строение мульферментного комплекса
- пируватдегидрогеназный комплекс (пируватдегидрогеназа), превращающий пируват в ацетил-SКоА,
- α-кетоглутаратдегидрогеназный комплекс (в цикле трикарбоновых кислот) превращающий α-кетоглутарат в сукцинил-SКоА,
- комплекс под названием «синтаза жирных кислот» (или пальмитатсинтаза), синтезирующий пальмитиновую кислоту
- карбамоилфосфатсинтетаза, первый фермент синтеза мочевины в печени и синтеза пиримидиновых оснований
Абзимы
Абзимами называются антитела , имеющие каталитическую функцию (англ. abzymes, antibodies as enzymes) и катализирующие конкретные реакции. Такая способность возникает в результате формирования промежуточного продукта при связывании антитела с антигеном (имитация переходного комплекса E-X ферментативной реакции).
Источник