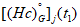- Состав и основные параметры природных газов
- 12 Таблицы данных
- «ГОСТ 31369-2021 (ISO 6976:2016). Межгосударственный стандарт. Газ природный. Вычисление теплоты сгорания, плотности, относительной плотности и числа Воббе на основе компонентного состава» (введен в действие Приказом Росстандарта от 12.10.2021 N 1106-ст)
Состав и основные параметры природных газов
Природные газы, добываемые из газовых и газоконденсатных месторождений, состоят из предельных углеводородов с общей формулой CnH2n+2 и неуглеводородных компонентов: азота (N2), углекислого газа (СО2), сероводорода (H2S), инертных газов (гелия, аргона, криптона, ксенона). Кроме того, природные газы насыщены парами воды, содержание которых зависит от давления, температуры, состава газа и воды. Число углеродных атомов в молекуле углеводородов п может достигать 17-40.
Метан (СН4), этан (С2Н6), этилен (С2Н4) при нормальных условиях (Рат = 0,1 МПа и Тст = 273К) являются реальными газами. Пропан (С3Н8), бутан (С4Н10) в нормальных условиях находятся в газообразном состоянии, при повышенных давлениях — в жидком состоянии, входят в состав сжиженных углеводородных газов. Углеводороды от (С5Н12) до (С17Н36) при нормальных условиях находятся в жидком состоянии. Все компоненты, входящие в состав природного газа, характеризуются строго индивидуальными свойствами.
По составу компонентов природные газы можно подразделить на три группы:
1. Газы, добываемые из чисто газовых месторождений. Это сухие
газы без тяжелых углеводородов.
2. Газы, добываемые с нефтью (попутный нефтяной газ), это физическая смесь сухого газа, сжиженного газа и газового бензина.
3. Газы, добываемые из газоконденсатных месторождений. Они со
стоят из сухого газа и жидкого углеводородного конденсата.
Наименьшей частицей, характеризующей вещество, является молекула, состоящая из атомов одного или нескольких элементов. За единицу измерения массы атомов и молекул условно принята 1/12 массы атома изотопа углерода. Масса атома элемента, выраженная в углеродных единицах, называется атомной массой элемента. Сумма атомных масс атомов, образующих молекулу, называется молекулярной массой вещества. Состав природного газа выражается в объемных или массовых долях единицы или процентах. Объемный состав примерно совпадает с молярным, так как объем 1.кмоля идеального газа при одинаковых физических условиях, по закону Авогадро, имеет одно и то же численное значение, в частности, при нормальных условиях равен 22,41 м 3 .
Объемный (молярный) состав газа можно пересчитать в массовый для каждого компонента смеси по формуле
где gi, — массовая доля i-гo компонента в газе;
Xi — объемная доля i-гo компонента;
Мi — молекулярная масса i-гo компонента.
Если состав природного газа задан в массовых долях, то для пересчета его в объемные (молярные) единицы используется формула
где mi — число молей i-гo компонента в смеси, и mi=gi / Mi.
Одним из основных параметров, характеризующим природный газ, является плотность. Плотность газа — масса единицы объема — равна отношению молекулярной массы газа к объему 1 моля. Плотность определяется по формуле
Размерность плотности в системе СИ — кг/м 3 , в системе СГС — г/см 3 .
Плотность газа известного состава определяется как сумма произведений плотности отдельных компонентов на их объемное (молярное) содержание Xi:
или по известным молекулярным массам:
Для практических расчетов часто используется относительная плотность газа по воздуху , равная отношению плотности газа к плотности воздуха , взятой при том же давлении и температуре:
т.к. при нормальных условиях равна 1.293 кг/м 3 . Относительная плотность удобна тем, что не зависит от температуры, давления.
Плотность природных газов при различных давлениях и температурах определяют по формуле
где z — коэффициент сверхсжимаемости природного газа.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник
12 Таблицы данных
«ГОСТ 31369-2021 (ISO 6976:2016). Межгосударственный стандарт. Газ природный. Вычисление теплоты сгорания, плотности, относительной плотности и числа Воббе на основе компонентного состава» (введен в действие Приказом Росстандарта от 12.10.2021 N 1106-ст)
Молярная масса и индексы числа атомов
для компонентов природного газа
Молярная масса, Mj, кг·кмоль -1
Примечание — Значения молярной массы, приведенные выше, получены взвешенным суммированием атомных масс (атомных весов) входящих в молекулу элементов, в соответствии с таблицей A.2 приложения A. Все десятичные знаки оставлены в этой таблице, т.е. округление до определенного числа знаков после запятой не применялось (за исключением воздуха). Значения стандартной неопределенности для молярных масс в данную таблицу не включены. При необходимости их вычисляют по формуле (27).
Коэффициенты суммирования для компонентов природного газа
при различных стандартных температурах измерений
Коэффициенты суммирования sj при различных стандартных температурах измерений
Примечание — Значения sj и u(sj), приведенные выше, относятся к давлению p0, равному 101,325 кПа.
Высшая молярная теплота сгорания для компонентов
природного газа при различных стандартных температурах
сгорания для идеального газа
Высшая теплота сгорания , кДж·моль -1 , идеального газа при различных стандартных температурах
1 Все значения для t1 = 25 °C взяты из [1], за исключением метана (j = 1), воды (см. примечание 2) и н-алканов C11 — C15. Значения для t1 = 20 °C, 15,55 °C, 15 °C и 0 °C получены путем пересчета из соответствующих значений при 25 °C.
2 Не равная нулю теплота сгорания воды (j = 42) выведена формально из определения высшей теплоты сгорания при условии конденсации до жидкого состояния всего водяного пара в продуктах горения. Таким образом, любой присутствующий водяной пар в газе вносит свой вклад скрытой теплоты испарения в высшую теплоту сгорания смеси. Значения стандартной энтальпии испарения воды приведены в таблице A.5 приложения A.
Источник