Химическая природа ферментов
1. Ферменты при гидролизе распадаются на аминокислоты.
2. Под действием кипячения и других факторов ферменты подвергаются денатурации и теряют каталитическую активность.
3. Осуществлено выделение ферментов в форме кристаллов белка.
4. Ферменты являются высокоспецифичными.
Прямым доказательством белковой природы ферментов является лабораторный синтез рибонуклеазы.
Выделяют простые ферменты, состоящие только из полипептидной цепи: трипсин, пепсин, рибонуклеаза, уреаза, фосфатаза и др.
Большинство природных ферментов — сложные белки. Их небелковые компоненты называются кофакторами; они необходимы для выполнения ферментом его каталитической роли. Кофакторами ферментов являются витамины или соединения, построенные с их участием (коэнзим А, НАД + , ФАД), фосфорные эфиры некоторых моносахаридов, ионы металов.
Кофермент — небелковый фактор, который легко отделяется от белковой части при диссоциации.
Простетическая группа – ковалентно связанный с белковой цепью небелковый компонент, который не отделяется при выделении и очистке фермента.
Апофермент – белковая часть фермента. В апоферменте есть участок, избирательно связывающий кофермент. Это кофермент связывающий домен. Его структура у различных апоферментов, соединяющихся с одним и тем же коферментом, сходна.
Весь фермент вместе с простетической группой называют холоферментом. Только объединение апофермента и кофермента обеспечивает активность холофермента.
Субстрат – вещество, подвергающееся превращениям под действием фермента.
Активный центр — специфический участок на поверхности фермента, связывающийся с молекулой субстрата и непосредственно участвующий в катализе. Активный центр у ферментов обычно располагается на дне щели или глубокой впадины (например, у трипсина). Активные центры ферментов образуются на уровне третичной структуры. У сложных ферментов в состав активного центра входят также простетические группы. Кофакторы ферментов выполняют функцию промежуточных переносчиков атомов или групп.
В активном центре различают два участка. Субстратный (связывающий) центр — участок, отвечающий за присоединение субстрата. Его называют контактной, или «якорной» площадкой фермента. Функция к аталитического центра — химическое превращение субстрата. В состав каталитического центра большинства ферментов входят цистеин, серин, гистидин, лизин, тирозин. Субстратный центр может совпадать (или перекрываться) с каталитическим центром.
Аллостерический центр — участок молекулы фермента вне его активного центра, который способен связываться с тем или иным веществом (лигандом). В результате изменяется третичная, а в ряде случаев и четвертичная структура белковой молекулы. Конфигурация активного центра претерпевает изменения, и, в свою очередь, изменяется каталитическая активность фермента. Так происходит аллостерическая регуляция активности ферментов. Ферменты, активность каталитического центра которых меняется под влиянием аллостерических эффекторов, называют аллостерическими.
Некоторые из ферментов являются полифункциональными, т. е. способны катализировать несколько химических превращений. Их белковая цепь образует несколько доменов, каждый из которых характеризуется своей каталитической активностью (например, алкогольдегидрогеназа не только катализирует реакцию окисления спиртов, но также реакции обезвреживания ряда ксенобиотиков).
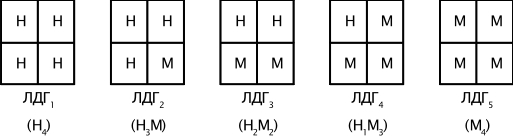
Изоферменты — это множественные формы фермента, катализирующие одну и ту же реакцию, но отличающиеся друг от друга по физическим и химическим свойствам: сродству к субстрату, активности, электрофоретической подвижности. Например, фермент лактатдегидрогеназа (ЛДГ) катализирует обратимое превращение пировиноградной кислоты в молочную. ЛДГ состоит из 4 субъединиц и содержит два типа полипептидных цепей: Н — сердечный тип (от англ. Heart — сердце) и М — мышечный тип (от англ. Muscle — мышца). Этот фермент благодаря различным сочетаниям субъединиц может существовать в 5 формах (рис. 14).
Для каждой ткани в норме характерно свое соотношение форм ЛДГ (изоферментный спектр). В сердечной мышце преобладает Н4, т.е. ЛДГ1, а в скелетных мышцах и печени – М4 (ЛДГ5). Изучение появления изоферментов ЛДГ в сыворотке крови позволяет судить о месте патологического процесса и о степени поражения органа или ткани.
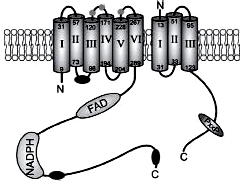
Особой формой существования ферментов являются мультимолекулярные ферментные комплексы. Существование таких комплексов ускоряет химические превращения. Метаболон — мультиэнзимный комплекс, обслуживающий единый многоступенчатый процесс биохимических превращений. Примерами являются метаболоны гликолиза, цикла Кребса, дыхательная цепь митохондрий, НАДФН-оксидаза (рис. 15) и др.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник
Большая Энциклопедия Нефти и Газа
Белковая природа ферментов обусловливает их неустойчивость ( лабильность), выражающуюся в том, что ферменты теряют активность в неблагоприятных условиях среды. Одним из важнейших факторов внешней среды является температура. С повышением температуры скорость ферментативного процесса, как и большинства химических реакций, возрастает, но в отличие от них в довольно узких пределах. По достижении определенной температуры, характерной для каждого фермента, наблюдается падение скорости ферментативной реакции. Уменьшение скорости связано с деструкцией белковой части фермента при повышенных температурах и потерей в результате этого каталитической активности. [1]
Белковая природа ферментов ограничивает их применение в медицинской практике. В организме, в частности в кровяном русле, находится значительное количество протеолитических ферментов, с большой скоростью гидролизующих чужеродные белки. Кроме того, большинство белков являются антигенами и при попадании в организм моментально блокируются соответствующими антителами. Несмотря на указанные ограничения, спектр применения различных ферментов в медицинской практике из года в год расширяется. При создании комплексных лекарственных форм на основе ферментов большое внимание уделяется соотношению отдельных компонентов. [2]
Вескими доказательствами белковой природы фермента являются его получение в чистом виде и выделение в форме кристаллов белка. К настоящему времени получено более 1000 кристаллических ферментов. [3]
Вильштеттера и др. Белковая природа ферментов была однозначно доказана в 1926 г. американским биохимиком Дж. [4]
Чувствительность к повышению температуры указывает на белковую природу фермента . [5]
Для ферментативных реакций Q10 изменяется в пределах от I до 2, что обусловлено белковой природой ферментов , особенностями протекания ферментативной реакции и внутренней среды организма. Влияние температуры на скорость ферментативной реакции очень многообразно. Она может прежде всего влиять на стабильность фермента, ускоряя денатурацию ферментативного белка, что связано с инактивацией фермента; на сродство фермента к субстрату; скорость распада фермент-субстратного комплекса, всегда образующегося при ферментативной реакции; на сродство фермента к активаторам и ингибиторам, если они имеются в системе. Повышение температуры, с одной стороны, ускоряет саму ферментативную ( каталитическую) реакцию; с другой стороны, ускоряется инактивация фермента. Таким образом, с повышением температуры при ферментативных реакциях, как и вообще при химических процессах, растет реакционная способность, истинная каталитическая активность. Но ферменты представляют собой белки, которые необратимо денатурируют при увеличении температуры выше 50 С, причем скорость денатурации при нагревании увеличивается во много раз быстрее, чем скорость любого химического превращения. Поэтому процесс инактивации, связанный с уменьшением концентрации фермента в системе, обусловливает при дальнейшем повышении температуры замедление реакции. [6]
Белковая природа ферментов объяснила многие детали их синтеза в клетках, причины, по которым они легко фиксируются на мембранах, и вместе с тем поставила важную проблему в теореии катализа — вопрос о механизме действия биологических катализаторов, которые, обладая очень сложной геометрической структурой, не являются вполне жесткими, подобно кристаллическим оксидам или металлам, а могут изменяться уже в процессе каталитической реакции. [7]
Ферменты могут быть определены как макромолекулярные катализаторы биологического происхождения. В этом определении нет указаний на белковую природу ферментов , и, действительно, можно допустить, что тот или иной фермент, не выделенный в чистом виде, окажется веществом небелковой природы. До сих пор, однако, подобные ферменты не были обнаружены, поэтому мы вправе определить ферменты также и как каталитически активные белки. [8]
Надо сказать, что авторы нового метода были абсолютно уверены в правильности своих выводов. Особенно энергично и последовательно отстаивал точку зрения о белковой природе ферментов Нортроп . Вместе с тем в научной печати, особенно в европейской, появились многочисленные рассуждения о том, что новый метод это лишь способ выделения фермента из раствора в адсорбированном на белке виде, что эти методы отнюдь не являются методами очистки ферментов. [9]
Ферменты, которые удалось выделить в кристаллическом состоянии, обладают очень высокой удельной активностью. Растворы кристаллических ферментов способны проявлять каталитические свойства при таких незначительных концентрациях фермента, при которых белковая природа фермента не может быть обнаружена обычными химическими реакциями на белок. [10]
Использование микробных ферментов в медицине весьма перспективно и, несомненно, будет расширяться. Трудности в применении ферментных препаратов для целей медицины состоят в необходимости очистки их от пирогенных веществ, токсинов и других примесей. Принимая во внимание белковую природу ферментов , необходимо проверять их на антигенное действие и аллергическую ре акцию организма. [11]
Самнер в 1926 г. первым неопровержимо доказал, что ферменты имеют белковую природу. С тех пор в кристаллическом виде получено уже более 100 ферментов, и все они оказались белками. В настоящее время вопрос о белковой природе ферментов решен настолько определенно, что под словом фермент автоматически подразумевается белок. [12]
Кристаллические ферменты обладают очень высокой каталитической активностью, не меняющейся при многократных перекристаллизациях. Было установлено также, что снижение активности фермента всегда сопровождается частичной денатурацией белка. Все эти факты заставили окончательно признать белковую природу ферментов . [13]
Это не значит, однако, что признание белковой природы ферментов было окончательно отвергнуто. [14]
Самнер не сдался и приступил к выполнению трудной задачи: доказать, что каталитическая активность является свойством самого белка. В качестве примера его работы упомянем об очистке специфического антитела антиуреазы; Самнер показал, что после частичного переваривания уреазы остаточная ферментативная активность точно соответствует количеству вещества осаждаемого антиуреазой. После работы Самнера многие ферменты были получены в кристаллическом виде и белковая природа ферментов перестала вызывать сомнения. [15]
Источник
Структура и общие свойства ферментов
Энзимология – наука о ферментах
Фермент – биологический катализатор белковой природы. Энзимология появилась на стыке химической, биологической и медицинской наук.
Значение ферментов
любые химические превращения веществ в организме происходят при участии ферментов, практическое применение ферментов во всех областях деятельности, где речь идёт о живых существах: • хлебопечение, • виноделие, • сыроварение, • чайное, кожевенное, меховое производство.
Значение ферментов
Инженерная энзимология
Иммобилизованная β-галактозидаза, присоединённая к магнитному стержню-мешалке, используется для снижения содержания молочного сахара в молоке, то есть продукта, который не расщепляется в организме больного ребёнка с наследственной непереносимостью лактозы. Методами генной инженерии получены L-треонин, витамин В 12 , интерфероны.
История развития энзимологии
Появилась энзимология в 1814 году, когда Кирхгоф показал, что в вытяжке из проросшего ячменя содержится вещество, которое вызывает превращение крахмала в сахар (амилаза). В 1836 году Т.Шванн выделил из желудочного сока пепсин. В настоящее время известно 10 000 ферментов, 500 получено в кристаллическом
Доказательства белковой природы ферментов
все выделенные ферменты – белки, методы получение ферментов и белков одинаковы, факторы, вызывающие денатурацию белка, вызывают инактивацию ферментов, при гидролизе ферменты дают аминокислоты, ферменты обладают высокой специфичностью.
Источник