Ферменты
Ферменты, или энзимы – это белковой природы, образующиеся и функционирующие во всех живых организмах. Слово фермент происходит от лат. fermentum – закваска, другое название ферментов – энзимы от греч. en zyme – в дрожжах.
Впервые ферментативные процессы были открыты в бродильном производстве. Современная ферментология или энзимология – это наука о ферментах, их структурной организации. Она решает задачи изучения механизмов действия ферментов, путей регуляции ферментной активности. Такой интерес к биокатализаторам не случаен. Ферменты – это важнейшие компоненты клетки, без них невозможны синтез, распад и взаимопревращения в живых организмах. Через ферментный аппарат и регуляцию его активности происходит и регуляция скорости метаболических реакций. Изучение важно для биологии, медицины, фармации, многих областей народного хозяйства. Установлено, что многие заболевания человека связаны с нарушением деятельности ферментов, целый ряд ферментов является лекарственными препаратами.
Общие и специфические свойства ферментов.
Являясь катализаторами, то есть веществами, ускоряющими реакции, ферменты имеют ряд общих свойств с химическими небиологическими катализаторами.
1. Ферменты и входят в состав конечных Р и выходят из реакции в неизменном виде, они не расходуются в процессе катализа.
2. Ферменты не могут возбудить реакций, противоречащим законам термодинамики, они ускоряют только те реакции, которые могут протекать и без них.
3. Ферменты, как правило, не смещают положения равновесия реакции, а лишь ускоряют его достижение.
Вместе с тем ферменты обладают и специфическими свойствами:
- По химическому строению ферменты являются белками (99,9).
- Эффективность ферментов на несколько порядков выше, чем небиологических катализаторов.
Например: H2O2 H2O + ½ O2 а) если реакция протекает без катализатора, то Еа = 75,7 кдж/моль, пузырьки О2 почти не видны; б) если прибавить катализатор небиологический то Еа = 54,1 кдж/моль, пузырьки отчетливо видны; в) если прибавить биологический катализатор каталазу, то Еа = 18 кдж/моль, раствор просто «кипит».
- Высокая специфичность – каждый фермент катализирует одну единственную реакцию или одну группу реакций, тогда как неорганические катализаторы действуют при различных типах реакций.
- Ферменты катализируют реакции в «мягких» условиях: при нормальном Р, рН = 7,0. Для неорганических катализаторов присуща необходимость экстремальных значений рН, нагревание до очень высоких температур.
Химическая природа и строение ферментов. Важным доказательством белковой природы ферментов явились работы Пастера (инактивация ферментов брожения при кипячении), Павлова (доказал белковую природу пепсина – фермента желудочного сока) и т.д. 1) важный признак белковой природы ферментов – их большая Mr. Например, у ДГ Mr = 4 10 6 ; 4,8 10 5 и т.д. 2) растворы ферментов имеют коллоидный характер – они не проходят через полунепроницаемую мембрану, осаждаются из растворов теми же реактивами, что и белки; 3) ферменты денатурируют и теряют свою активность под влиянием высокой температуры, УЗ, сильных щелочей и других факторов; 4) ферменты, как и белки, обладают амфотерными свойствами, электрофоретической подвижностью и рI. 5) как и белки, ферменты обладают высокой специфичностью; 6) наконец, прямым доказательством белковой природы ферментов явился искусственный синтез ферментов (рибонуклеаза, лизоцим), которые не отличаются по свойствам и биологической активности от природных аналогов.
| Ферменты | |
 | |
| простые белки | сложные белки |
| состоят только из ППЦ | состоят из ППЦ + небелковый компонент |
| (гидролитические ферменты – пепсин, трипсин, уреаза и др.) или ферменты–протеины | (ацетил КоА, лактат ДГ и т.д.) или ферменты–протеиды |
В ферментах-протеидах белковая часть называется апоферментом, а небелковая – простетической группой. Общее название сложных ферментов –холофермент. Если простетическая группа слабо связана с белковой частью и легко диссоциирует, она называется коферментом. Кофермент может соединяться с разными белками, и именно белковая часть определяет специфичность действия сложных ферментов. Вместе с тем, без кофермента сложный фермент не может функционировать, так как кофермент, как правило, непосредственно контактирует с субстратом (S) и служит в качестве переносчика ē, атомов или группы атомов. Кофакторы, или коферменты это: 1) ионы Me – Mg 2+ , Ca 2+ , Cu 2+ , Mn 2+ b lh/$ 2) витамины и их фосфорные эфиры – витамин Н (биотин)(в составе коферментов карбоксилирования), липоевая, фолиевая кислоты, В1 и др.; 3) мононуклеотиды ФМН, АТФ, ГТФ и т.д.; 4) большая часть коферментов – это динуклеотиды НАД, НАДФ, HS-KoA и др. При гиповитаминозах и авитаминозах недостаток витаминов ослабляет биосинтез многих ферментов и вызывает гипокоферментоз. Коферменты выполняют также важную роль в стабилизации и охране апоферментов. Последние без коферментов скорее разрушаются протеолитическими ферментами. Таким образом, сами по себе ни коферменты, ни апоферменты каталитической активностью не обладают, а только в комплексе друг с другом. Молекулы S-в чаще всего имеют небольшие размеры по сравнению с молекулами ферментов, поэтому при образовании Е-S-го комплекса в контакт с S вступает ограниченная часть аминокислот ППЦ, которая называется активным центром (АЦФ). У Е-протеидов в состав АЦФ входят также и простетические группы. Таким образом, активный центр фермента – это уникальная комбинация аминокислотных остатков, обеспечивающих непосредственное взаимодействие Е иSи прямое участие в акте катализа.
| АЦФ | |
 | |
| связывающий центр | каталитический центр |
| участок, где происходит связывание Sи Е – это контактная или «якорная» площадка | участок, где происходит превращение Sпосле его связывания |
При сближении Е и S и образовании ЕS-комплекса нуклеофильные и электрофильные группы АЦФ, отдавая или принимая ē-ны, тем самым как бы «расшатывают» электронную структуру S, активируя его и ускоряя химическую реакцию. Есть ферменты, имеющие несколько АЦФ – уреаза–3; алкоголь ДГ–4; ацетилхолингетераза – 25-30 АЦФ у разных животных. Аллостерические центры ферментов. Кроме АЦФ, у ферментов имеются и аллостерические ( греч. allos – другой) или инопространственные центры. Это место воздействия на ферменты разных регуляторных факторов. Взаимосвязь между АЦФ и АЛЦФ называется аллостерическими взаимодействиями. Важная особенность АЛЦФ – их более высокая по сравнению с АЦФ чувствительность к различным воздействиям. Например, при повышении температуры и применении рН раньше затормаживается функция АЛЦФ. В частности, при повышении температуры аллостерический центр гексокиназы теряет чувствительность к регуляторному воздействию инсулина и глюкокортикоидов, а функциональная активность ферментов сохраняется и продолжает фосфорилировать глюкозу за счет АТФ. 
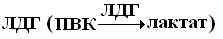
Источник
Химическая природа ферментов
Ферменты, или энзимы — вещества белковой природы, обладающие каталитической активностью. Термин «энзим» — от греч. en zyme- в дрожжах, «фермент» — от лат. fermentatio — брожение.
Учение о ферментах выделено в самостоятельную науку энзимологию.
Хотя уже осуществлен лабораторный синтез ряда ферментов — рибонуклеазы, лизоцима, единственный способ получения ферментов — это выделение их из биологических объектов.
Доказательства белковой природы ферментов:
1. Ферменты при гидролизе распадаются на аминокислоты.
2. Под действием кипячения и др. факторов ферменты подвергаются денатурации и теряют каталитическую активность.
3. Осуществлено выделение ферментов в форме кристаллов белка.
4. Ферменты оказывают высокоспецифическое действие.
Прямым доказательством белковой природы ферментов является лабораторный синтез первого фермента – рибонуклеазы.
Выделяют простые ферменты, состоящие только из полипептидной цепи: пепсин, трипсин, уреаза, рибонуклеаза, фосфатаза и др.
Большинство природных ферментов — сложные белки. Их небелковые компоненты называются кофакторами и необходимы для выполнения ферментом его каталитической роли. Кофакторами ферментов являются витамины или соединения, построенные с их участием (коэнзим А, НАД + , ФАД); фосфорные эфиры некоторых моносахаридов, ионы металов.
Кофермент — небелковый фактор, который легко отделяется от белковой части — апофермента при диссоциации.
Простетическая группа – ковалентно связанный с белковой цепью небелковый компонент, который не отделяется при выделении и очистке фермента.
Весь фермент вместе с простетической группой назыывают холоферментом. Только объединение апофермента и кофермента обеспечивает активность холофермента.
Субстрат – вещество, подвергающееся превращениям под действием фермента.
Активный центр — специфический участок на поверхности фермента, связывающийся с молекулой субстрата и непосредственно участвующий в катализе. Активные центры ферментов образуются на уровне третичной структуры. У сложных ферментов в состав активного центра входят также простетические группы. Кофакторы ферментов выполняют роль промежуточных переносчиков атомов или групп.
В активном центре различают два участка. Субстратный (связывающий) центр — участок, отвечающий за присоединение субстрата. Его называют контактной, или «якорной» площадкой фермента. Каталитический центр отвечает за химическое превращение субстрата. В состав каталитического центра большинства ферментов входят такие аминокислоты, как серин, цистеин, гистидин, тирозин, лизин. Субстратный центр может совпадать (или перекрываться) с каталитическим центром.
Аллостерический центр — участок молекулы фермента вне его активного центра, который способен связываться с тем или иным веществом (лигандом). В результате изменяется третичная, а часто и четвертичная структура белковой молекулы. Как следствие изменяется конфигурация активного центра и каталитическая активность фермента. Это т. н. аллостерическая регуляция активности ферментов. Ферменты, активность каталитического центра которых подвергается изменению под влиянием аллостерических эффекторов, называют аллостерическими.
Некоторые из ферментов являются полифункциональными, т. е. обладают несколькими энзиматическими активностями, но всего лишь одной полипептидной цепью. Их белковая цепь образует несколько доменов, каждый из которых характеризуется своей каталитической активностью. Например, алкогольдегидрогеназа не только катализирует реакцию окисления спиртов, но также реакции обезвреживания ряда ксенобиотиков.
Изоферменты — это множественные формы фермента, катализирующие одну и ту же реакцию, но отличающиеся друг от друга по физическим и химическим свойствам — сродству к субстрату, активности, электрофоретической подвижности.
Например, фермент лактатдегидрогеназа катализирует обратимое превращение пировиноградной кислоты в молочную. Она состоит из 4 субъединиц и содержит два типа полипептидных цепей: Н- сердечный тип (от англ. heart- сердце) и М — мышечный тип (от англ. muscle- мышца). Этот фермент благодаря различным сочетаниям субъединиц может существовать в 5 формах:
Для каждой ткани в норме характерно свое соотношение форм (изоферментный спектр) ЛДГ. Например, в сердечной мышце преобладает Н4, т.е. ЛДГ1, а в скелетных мышцах и печени – М4 (ЛДГ5). Изучение появления изоферментов ЛДГ в сыворотке крови позволяет судить о месте патологического процесса и о степени поражения органа или ткани.
Особую группу ферментов составляют мультимолекулярные ферментные комплексы. Существование таких комплексов ускоряет химические превращения. Если мультиэнзимный комплекс обслуживает единый, многоступенчатый процесс биохимических превращений, его называют метаболоном. Таковы метаболоны гликолиза, цикла Кребса, дыхательная цепь митохондрий и др.
Источник