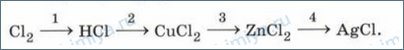- Опыт 5. Зависимость степени диссоциации от природы электролита
- Опыт 6. Образование слабого электролита
- Опыт 7. Действие одноименного иона на степень диссоциации слабого электролита
- Задачи и упражнения
- § 23. Соединения галогенов —
- §23. Соединения галогенов — cтраницы 167, 168, 169, 170, 171, 172, 173
- Несколько вопросов по химии.
- Докажите зависимость степени электролитической диссоциации от природы
Опыт 5. Зависимость степени диссоциации от природы электролита
Проводится реакция взаимодействия металлического цинка с соляной и уксусной кислотами. Концентрация кислот одинаковы. Скорость реакции будет зависеть от концентрации ионов Н + в растворе, то есть от степени диссоциации исследуемых кислот.
В одну пробирку налейте 1-2 мл раствора соляной кислоты (2н), в другую — столько же раствора уксусной кислоты (2н). В каждую пробирку опустите по кусочку металлического цинка примерно одинакового размера.
Запишите, в какой пробирке выделение водорода идет более энергично. Напишите уравнения реакций Zn с HCl и CH3COOH в молекулярном и ионном виде. Рассчитайте концентрацию ионов Н + и величину рН в 0,1н растворе HCl и 0,1н растворе CH3COOH (К = 1,810 -5 ). Сделайте вывод, какой из электролитов имеет более высокое значение степени диссоциации — HCl или CH3COOH.
Опыт 6. Образование слабого электролита
В одну пробирку налете 5-6 капель раствора ацетата натрия СH3COONa, а в другую — столько же раствора хлорида аммония NH4Cl. В первую пробирку прибавьте несколько капель 2н раствора HCl, а во вторую — несколько капель 2н раствора NaOH. Пробирки нагрейте на водяной бане и испытайте на запах. Напишите молекулярные и ионные уравнения реакций:
Опыт 7. Действие одноименного иона на степень диссоциации слабого электролита
а) В две пробирки налейте по 5-6 капель 2н раствора СH3COOH и прибавьте по 1 капле индикатора метилоранжа. Одну пробику оставьте для сравнения, а в другую добавьте немного сухого CH3COONa и перемешайте. Наблюдайте изменение окраски индикатора и объясните наблюдаемое изменение.
б) Аналигичный опыт выполните с раствором NH4OH. Используйте индикатор фенолфталеин, а в качестве сильного электролита — кристаллический NH4Cl. Как изменяется цвет индикатора и почему?
Напишите уравнения диссоциации электролитов и покажите направление смещения ионного равновесия в растворе слабого электролита при введении одноименного иона.
Задачи и упражнения
2. Напишите уравнения диссоциации по первой и по второй ступени сероводородной кислоты H2S и сернистой кислоты H2SO3. Найдите в таблицах величины констант диссоциации этих кислот. Определите, какая кислота сильнее?
3. В каком направлении будет смещаться равновесие реакции: 2H + + 2CrO4 2- Cr2O7 2- + H2O, при добавлении а) кислот, б) щелочей? Почему?
4. В каком из 0,1М растворов – CH3COOH или CH3COONa – содержится больше ацетат ионов? Вычислите концентрацию ацетат ионов в каждом из растворов.
5. В пробирку с соляной кислотой и цинком добавили раствор ацетата натрия. Как при этом меняется скорость выделения водорода? Как меняется концентрация ионов водорода в растворе, если к 100 мл 0,2М раствора HCl прибавить 100 мл 0,2М раствора CH3COONa?
6. Определите степень диссоциации следующих растворов: а) 0,05М HNO2, б) 1М HF, в) 0,2М CH3COOH, г) 0,01М HCN.
7. Определите молярную концентрацию раствора кислоты, если степень диссоциации равна: а) 1% для CH3COOH, б) 0.1% для HClO, в) 0,01% для HCN, г) 5% для HF.
8. Вычислите ионную силу и активности ионов в растворах: а) 0,01М NaCl, б) 0,01М CuSO4, в) 0,01М FeCl3, в) 0,01М Al2(SO4)3.
9. Напишите в молекулярном и ионном виде уравнения реакций доказывающих амфотерный характер следующих гидроксидов: а) Be(OH)2, б) Cr(OH)3, в) Pb(OH)2, г) Al(OH)3.
Лабораторная работа 5.
Источник
§ 23. Соединения галогенов —
Электролитическая диссоциация увеличивается от HF к HI.
Самая сильная из галогеноводородных кислот— иодоводородная, а самая слабая — фтороводородная. Большая прочность химической связи H-F (фтороводородная кислота слабо диссоциирует в воде) обусловлена малым размером атома F и соответствующим малым расстоянием между ядрами атомов водорода и фтора. С ростом радиуса атома от F к I растет и межъядерное расстояние, прочность молекул уменьшается и соответствующая способность к электролитической диссоциации увеличивается.
2. В четырех пробирках находятся прозрачные растворы фторида, хлорида, бромида и иодида натрия. Как распознать эти вещества с помощью одного реактива?
3. Напишите не менее четырех-пяти уравнений реакций получения хлорида магния. Там, где это имеет место, запишите и ионные уравнения и рассмотрите окислительно-восстановительные процессы.
4. Напишите уравнения химических реакций, иллюстрирующие следующие превращения: Укажите окислительно-восстановительные реакции и разберите их. Уравнения реакций с участием электролитов запишите также в ионной форме.
Источник
§23. Соединения галогенов — cтраницы 167, 168, 169, 170, 171, 172, 173
Электролитическая диссоциация увеличивается от HF к HI.
Самая сильная из галогеноводородных кислот— иодоводородная, а самая слабая — фтороводородная. Большая прочность химической связи H-F (фтороводородная кислота слабо диссоциирует в воде) обусловлена малым размером атома F и соответствующим малым расстоянием между ядрами атомов водорода и фтора. С ростом радиуса атома от F к I растет и межъядерное расстояние, прочность молекул уменьшается и соответствующая способность к электролитической диссоциации увеличивается.
2. В четырех пробирках находятся прозрачные растворы фторида, хлорида, бромида и иодида натрия. Как распознать эти вещества с помощью одного реактива?
3. Напишите не менее четырех-пяти уравнений реакций получения хлорида магния. Там, где это имеет место, запишите и ионные уравнения и рассмотрите окислительно-восстановительные процессы.
4. Напишите уравнения химических реакций, иллюстрирующие следующие превращения:
Укажите окислительно-восстановительные реакции и разберите их. Уравнения реакций с участием электролитов запишите также в ионной форме.
Сохраните или поделитесь с одноклассниками:
Источник
Несколько вопросов по химии.
1) Докажите зависимость степени электролит. диссоциации от природы электролита на примере галогеноводородных кислот.
2) В четырех пробирках находятся прозрачные растворы фторида, хлорида, бромида и йодида натрия. Как распознать данные вещества с помощью одного реактива?
3) Напишите не менее четырех уравнений реакций получения Хлорида натрия.
1. Сравни степень диссоциации в ряду от HF до HJ, вот тебе и ответ!
2. Подумай, какие осадки образуются при добавлении AgNO3.
Удачи!
На вопросы такого типа здесь редко отвечают, ты зашёл не туда куда нужно. Всё равно желаю удачи в учёбе.
PbCl2 + 2NaOH (разб. ) = Pb(OH)2↓ + 2NaCl
PbCl2 + 4NaOH (конц. ) = Na2[Pb(OH)4] + 2NaCl
2PbCl2 + Na2CO3 (разб. ) + 2NaOH (разб. ) = Pb2CO3(OH)2↓ + 4NaCl
PbCl2 + 4Na2SO3S (конц. , хол. ) = Na6[Pb(SO3S)4) + 2NaCl
PbCl4 + 4NaOH (разб. ) = PbO2↓ + 4NaCl + 2H2O
PbCl4 + 6NaOH (конц. ) = Na2[Pb(OH)6] + 4NaCl
Na2[Pb(OH)6] + 2HCl (разб. ) = 2NaCl + PbO2↓ + 4H2O
Na2[Pb(OH)6] + 6HCl (конц. ) = PbCl2↓ + Cl2↑ + 2NaCl + 6H2Oкип.
2(NH3•H2O) + NaCIO (конц. ) = N2H4•H2O + NaCl + 3H2Oкип.
NH4Cl + NaOH (насыщ. , гор. ) = NaCl + NH3↑ + H2O
NH4Cl + Na(Hg)(ж) = NaCl + NH04(Hg) ↓
N2H5Cl + NaOH (конц. ) = N2H4•H2O + NaCl
(NH3OH)Cl + NaOH (конц. ) = NH2OH•H2O + NaCl
3(NH3OH)Cl + Na3PO4 = (NH3OH)3PO4↓ + 3NaCl
(NH3OH)Cl + Na(C2H5O) = NH2OH + NaCl↓ + C2H5OH0° C, в этаноле
(NH3OH)Cl + 3Na(C2H5O) + C2H5NO3 = Na2N2O3 + NaCl↓ + 4C2H5OHкип
NaN3(т) + HCl (20%-я) = NaCl + HN3↑комн.
NaN3 + 4HCl (конц. ) = Cl2↑ + NH4Cl + NaCl + N2↑кат. Pt
NaN3 + (NO)Cl = NaCl + N2 + N2O40—50° C
4NaN3 (конц. ) + CdCl2 = Na2[Cd(N3)4] + 2NaCl
Na2N2O2 + 2HCl (конц. ) = 2NaCl + H2O + N2O↑кип.
Na2N2O2 + 2HCl = H2N2O2 + 2NaCl0° C, в эфире
NaNO2 + HCl (разб. ) = NaCl + HNO2комн.
4NH2Cl + 4NaOH (разб. ) = N2↑ + 2(NH3•H2O) + 3NaCl + NaClO + H2Oτ = 3÷4,5 ч
Источник
Докажите зависимость степени электролитической диссоциации от природы
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Mg + 2HCl = MgCl2 + H2↑
Схема окислительно-восстановительной реакции.
Mg 0 + 2H +1 Cl ⟶ Mg +2 Cl2 + H2 0
Mg 0 -2ē ⟶ Mg +2 |2 |2|1 ― процесс окисления
2H +1 +2ē ⟶ H2 0 | 2| |1 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы магния и водорода. Находим наименьшее общее кратное для чисел 2 и 2. Это число 2, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 2 и 2, записываем результат за третьей чертой в строках, касающихся элементов магния и водорода. Множители 1 и 1 являются искомыми коэффициентами. Поскольку эти элементы изменили степень окисления полностью (в правой части схемы эти элементы ни в одном веществе не проявляют такую же степень окисления, как в исходном веществе) и одинаковыми являются индексы элемента магния в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 1 (который обычно не пишем) перед формулой двух соединений магния (Mg, MgCl2), а разными являются индексы элемента водорода в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 1 (который обычно не пишем) перед формулой водорода. Подбираем коэффициенты для остальных соединений.
В приведённой реакции магний — восстановитель, соляная кислота (за счёт атомов водорода в степени окисления +1) — окислитель.
MgO + 2HCl = MgCl2 + H2O
MgO + 2H + + 2Cl — = Mg 2+ + 2Cl — + H2O
MgO + 2H + = Mg 2+ + H2O
Упражнение 4 Напишите уравнения химических реакций, иллюстрирующие следующие превращения:
Cl2 1 ⟶ HCl 2 ⟶ CuCl2 3 ⟶ ZnCl2 4 ⟶ AgCl Укажите окислительно-восстановительные реакции и разберите их. Уравнения реакций с участием электролитов запишите также в ионной форме.
1) H2 + Cl2 = 2HCl
Схема окислительно-восстановительной реакции.
H2 0 + Cl2 0 ⟶ H +1 Cl -1
Восстановитель H2 0 -2ē ⟶ 2H +1 |2 |2|1 ― процесс окисления
Окислитель Cl2 0 +2ē ⟶ 2Cl -1 | 2| |1 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы водорода и хлора. Находим наименьшее общее кратное для чисел 2 и 2. Это число 2, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 2 и 2, записываем результат за третьей чертой в строках, касающихся элементов водорода и хлора. Множители 1 и 1 являются искомыми коэффициентами. Поскольку эти элементы изменили степень окисления полностью (в правой части схемы эти элементы ни в одном веществе не проявляют такую же степень окисления, как в исходном веществе) и разными являются индексы этих элементов в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 1 (который обычно не пишем) перед формулой водорода H2 и хлора Cl2. Подбираем коэффициенты для остальных соединений.
2) CuO + 2HCl = CuCl2 + H2O
CuO + 2H + + 2Cl — = Cu 2+ + 2Cl — + H2O
CuO + 2H + = Cu 2+ + H2O
3) CuCl2 + Zn = ZnCl2 + Cu
Схема окислительно-восстановительной реакции.
Cu +2 Cl2 + Zn 0 ⟶ Zn +2 Cl2 + Cu 0
Zn 0 -2ē ⟶ Zn +2 |2|2|1 ― процесс окисления
Cu +2 +2ē ⟶ Cu 0 |2| |1 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы цинка и меди. Находим наименьшее общее кратное для чисел 2 и 2. Это число 2, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 2 и 2, записываем результат за третьей чертой в строках, касающихся элементов цинка и меди. Множители 1 и 1 являются искомыми коэффициентами. Поскольку эти элементы изменили степень окисления полностью (в правой части схемы эти элементы ни в одном веществе не проявляют такую же степень окисления, как в исходном веществе) и одинаковыми являются индексы этих элементов в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 1 (который обычно не пишем) перед формулой всех соединений цинка (Zn, ZnCl2) и меди (CuCl2, Cu).
В приведённой реакции цинк ― в осстановитель, хлорид меди (II) (за счёт атомов меди в степени окисления +2) — окислитель.
4) ZnCl2 + 2AgNO3 = Zn(NO3)2 + 2AgCl↓
Zn 2+ + 2Cl — + 2Ag + + 2NO3 — = Zn 2+ + 2NO3 — + 2AgCl↓
2Ag + + 2Cl — = 2AgCl↓ :2
Ag + + Cl — = AgCl↓
Источник