Двойственная природа электрона
Подтвержденная экспериментально в 1927 г. двойственная природа электрона, обладающего свойствами не только частицы, но и волны, побудила ученых к созданию новой теории строения атома, учитывающей оба этих свойства. Современная теория строения атома опирается на квантовую механику.
Двойственность свойств электрона проявляется в том, что он, с одной стороны, обладает свойствами частицы (имеет определенную массу покоя), а с другой — его движение напоминает волну и может быть описано определенной амплитудой, длиной волны, частотой колебаний и др. Поэтому нельзя говорить о какой-либо определенной траектории движения электрона — можно лишь судить о той или иной степени вероятности его нахождения в данной точке пространства.
Следовательно, под электронной орбитой следует понимать не определенную линию перемещения электрона, а некоторую часть пространства вокруг ядра, в пределах которого вероятность пребывания электрона наибольшая. Иными словами электронная орбита не характеризует последовательность перемещения электрона от точки к точке, а определяется вероятностью нахождения электрона на определенном расстоянии от ядра.
ψ — волновая функция (аналог амплитуды для волнового движения в классической механике), которая характеризует движение электрона в пространстве как волнообразное возмущение
Электро́нная пло́тность — плотность вероятности обнаружения электрона в данной точке пространства.
Рассмотрим водородоподобный атом — систему из двух зарядов: положительно заряженного тяжёлого ядра, окруженного симметричной сферой отрицательного электричества — электроном, вероятность обнаружения которого распределена сферически симметрично вокруг ядра; изображается в виде облака. Таким образом, у атома водорода (и ему подобных) в основном состоянии электронная плотность зависит только от расстояния до ядра и одинакова в любой точке сферы. Это состояние электрона характеризуется нулевым орбитальным моментом импульса (так называемое s-состояние). В возбуждённых состояниях с отличным от нуля орбитальным моментом электрона (p-, d-, f-. состояния) сферическая симметрия электронной плотности отсутствует.
характеристика состояния электрона системой квантовых чисел
Квантовые числа – целые или дробные числа, определяющие возможные значения физических величин, характеризующих квантовую систему (молекулу, атом, атомное ядро, элементарную частицу). Квантовые числа отражают дискретность (квантованность) физических величин, характеризующих микросистему. Набор квантовых чисел, исчерпывающе описывающих микросистему, называют полным
- Главное квaнтовое число n (рано номеру периода элемента) определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .)
- Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n-1 (l = 0, 1, 2, 3. n-1).Каждому значению l соответствует орбиталь особой формы. Орбитали с l = 0 называются s-орбиталями, l = 1 – р-орбиталями (3 типа, отличающихся магнитным квантовым числом m), l = 2 – d-орбиталями (5 типов), l = 3 – f-орбиталями (7 типов).
- Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Его значения изменяются от +lдо —l, включая 0. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО: рx, рy, рz.
- Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2.Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином (от англ. веретено). Для обозначения электронов с различными спинами используются символы:
и
.
ногоэлектронных атомов. Принцип наименьшей энергии. Принцип Паули. Правило Хунда. Правило Клечковского. Электронные и электронно-графические формулы атомов элементов в основном и возбужденном состоянии.
Максимальное число электронов на энергетическом уровне определяется как 2n 2 , а на подуровне – как 2(2l+1)
Число электронов, которые могут находиться на одном энергетическом уровне, определяется формулой 2n2, где n – номер уровня. Максимальное заполнение первых четырех энергетических уровней: для первого уровня – 2 электрона, для второго – 8, для третьего – 18, для четвертого – 32 электрона. Максимально возможное заполнение электронами более высоких энергетических уровней, в атомах известных элементов не достигнуто. Квантово-механические расчеты показывают, что в многоэлектронных энергия электронов одного уровня неодинакова; электроны заполняют атомные орбитали разных видов и имеют разную энергию. Каждый энергетический уровень, кроме первого, расщепляется на такое число энергетических подуровней, сколько видов орбиталей включает этот уровень. Второй энергетический уровень расщепляется на два подуровня (2s – и 2p-подуровни), третий энергетический уровень – на три подуровня (3s-, 3p- и 3d-подуровни). Каждый s-подуровень содержит одну s орбиталь, каждый р-подуровень – три р-орбитали, каждый d-подуровень семь f-орбиталей. Закономерность заполнения электронных оболочек атомов определяется принципом запрета, установленным в 1925 г швейцарским физиком Паули
(принцип Паули): В атоме не могут одновременно находиться два электрона с одинаковым набором четырех квантовых квантовых чисел (заполнение электронами орбиталей происходит следующим образом: сначала на каждой орбитали располагается по одному электрону, затем, после заполнения всех орбиталей происходит распределение вторых электронов с противоположным спином).
Используя понятия квантовые числа можно сказать, что: Каждый электрон в атоме однозначно характеризуется своим набором четырех квантовых чисел — главного n, орбитальногоl, магнитного ml, и спинового ms. Заселение электронами энергетических уровней, подуровней и атомных орбиталей подчиняется следующему правилу:
В невозбужденном атоме все электроны обладают наименьшей энергией (принцип наименьшей энергии). Это означает, что каждый из электронов, заполняющих оболочку атома, занимает такую орбиталь, чтобы атом в целом имел минимальную энергию. Последовательно квантовое возрастание энергии подуровней происходит в следующем порядке: 1s — 2s -2р — 3s – 3р — 4s –3d — 4р — 5s -…. Такой порядок увеличения энергии подуровней определяет расположение эле Ментов в Периодической системе. Заполнение атомных орбиталей внутри одного энергетического подуровня происходит в соответствии с правилом, сформулированным немецким физиком Ф. Хундом (1927г)
(правило Хунда): При данном значении квантового числа l (т.е. в пределах одного подуровня) в основном состоянии электроны располагаются таким образом, что значение суммарного спина атома максимально. Это означает, что на подуровне должно быть максимально возможное число неспаренных электронов. Порядок возрастания энергии атомной орбитали в сложных атомах описывается
правилом Клечковского: энергия атомной орбитали возрастает в соответствии с увеличением n +l главного и орбитального квантовых чисел. При одинаковом значении суммы энергия меньше у атомной орбитали с меньшим значением главного квантового числа.
Распределение электронов по различным атомным орбиталям называют электронной конфигурацией атома. Электронная конфигурация с наименьшей энергией соответствует основному состоянию атома, остальные конфигурации относятся к возбужденным состояниям. Электронную конфигурацию атома изображают двумя способами – в виде электронных формул и электронно-графических диаграмм. При написании электронных формул используют главное и орбитальное квантовые числа. Подуровень обозначают с помощью главного квантового числа (цифрой) и орбитального квантового числа (соответствующей буквой). Число электронов на подуровне характеризует верхний индекс. Например. Для основного состоянии атома водорода электронная формула: 1s1. Более полно строение электронных подуровней можно описать с помощью электронографических диаграмм, где распределение электронов по подуровням представляют в виде квантовых ячеек. Орбиталь в этом случае принято условно изображать квадратом, около которого проставлено обозначение подуровня. Подуровни на каждом уровне должны быть немного смещены по высоте, так как их энергия несколько различается. Электроны обозначают стрелками или ¯ в зависимости от знака спинового квантового числа. С учетом структуры электронных конфигураций атомов все известные элементы в соответствии со значением орбитального квантового числа последнего заполняемого подуровня можно разбить на четыре группы: s –элементы, р-элементы, d-элементы, f-элементы.
Источник
Вопрос № 3 Двойственная природа электрона. Корпускулярные и волновые свойства электрона. Уравнение де Бройля.
В 1913г. Нильс Бор предложил теорию строения атома водорода, в которой связал планетарную модель атома с квантовой теорией излучения Планка и учения Эйнштейна о световых квантах. Бор показал, что если квантуется вся энергия, то энергия электрона тоже должна квантоваться.
В 1900 Планк доказал, что чистая энергия излучается квантом, энергия одного кванта рассчитывается по простой формуле.
E=h , где h-постоянная Планка, v-частота квантовой колебаний: h=6,626 10 -34 Дж*Сек.
С= * Е= =
E =mc 2 mc 2 = =
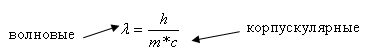
Волновые — = — корпускулярные
Уравнение показывает корпускулярные – волновые свойства фотона
В своих постулатах Бор учитывал, что энергия электрона в атоме изменяется скачкообразно – дискретно.
1. Электрон вращается вокруг ядра не по любым орбитам, а по стационарным, радиусы которых относятся к квадрату целых чисел.
2. Двигаясь по стационарной орбите электрон энергию не излучает и не поглощает, он находится в основном состоянии r1=0,053 Hм.
3. Излучение или помещение энергии происходит, при переходе электрона с одной орбиты на другую.
∆Е=Ен-Ек ∆Е=h =
После постулатов Бора появился новый раздел в физике, изучающий свойства и поведения частиц микромира (с малой массой) это так называемая квантовая или волновая механика.
Дополнение к постулатом Бора Зоммерфельд предложении эллипсовидные орбитами
Квантовая механика основывается на представлениях о квантовании энергии, волновом характере движения микрочастиц вероятностном методе описания микрообъектов.
Основное уравнение квантовой механики — двойственная природа фотонов
В 1924 г. Луи де Бройль применил это уравнение для описания поведения электрона.
Заменив скорость света на скорость движения электрона, таким образом было доказано, что электрон обладит корпускулярно-волновыми свойствами
Частица m=1гр, v=5м/сек, 1,3*10 -31 м=1,3*10 -29 см
В 1927 году Девиссон и Джермер (США) Томсон (Англия), Тарковский (Россия) обнаружили независимо друг от друга дифракцию и интерференцию у электронов.
Электрон обладает дуализмом – это одновременно и частица и волна. Учесть двойственную природу электрона позволяет принцип неопределенности Гейзенберга невозможно одновременно определимо точно и скорость движения электрона и его координаты.
, v – скорость движения , q – координаты
В связи с этим в квантовой механике состояние микрочастицы описывается не ее координатой и скоростью, а каждого функций (пси) (волновая функция).
Квантовая механика отказывается от уточнения положения электрона в пространстве е и заменяет это понятие вероятностью пребывания электрона в данной точке около ядерного пространства.
= (x,y,z)
В качестве модели состояния электронов в атоме в квантовой механике принято представление об электронном облаке.
Плотность соответствующих участков которого пропорциональна вероятности нахождение там электрона.
П ространство вокруг ядра в котором наиболее вероятно пребывание электрона называется орбиталь.
Исходя из представления о наличии у электрона волновых свойств. Шредингер в 1925 г. предположил, что состояние движущегося в атоме электрона должно описываться известным в физике уравнением стоячей электромагнитной волны. Подставив в это уравнение вместо длины волны ее значение из уравнения де Бройля, он получил новое уравнение, связывающее энергию электрона с пространственными координатами в этом уравнении амплитуде трехмерного волнового процесса.
Особенно важное значение для характеристики состояния электрона имеет волновая функция . Подобно амплитуде любого волнового процесса, она может принимать как положительные, так и отрицательные значения. Однако величина в данной области пространства, тем выше вероятность, того, что электрон проявит здесь своё действие, т. е. что его существование будет обнаружено в каком-либо физическом процессе.
Более точным будет следующее утверждение: вероятность обнаружения электрона в некотором малом объеме выражается произведением .Таким образом сама величина выражает плотность вероятности нахождения электрона в соответствующей области пространства.
Для электрона, находящегося под действием сил притяжения к ядру, уравнение Шледингера имеет решение не при любых, а только при определенных значениях энергии. Таким образом, квантованность энергетических состояний электрона в атоме оказывается следствие5м присущих электрону волновых свойств и не требует введения особых постулатов.
Источник
 и
и  .
.