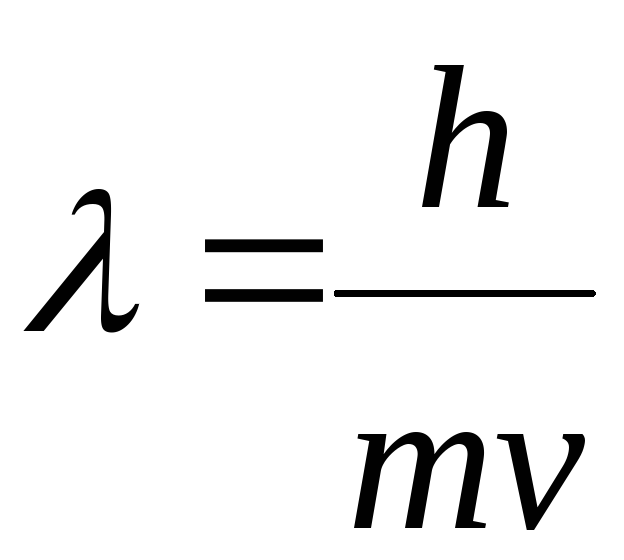2.4. Двойственная природа электрона
В 1905 г. А. Эйнштейн предсказал, что любое излучение представляет собой поток квантов энергии, называемых фотонами. Из теории Эйнштейна следует, что свет имеет двойственную (корпускулярно-волновую) природу.
В 1924 г. Луи де Бройль (Франция) выдвинул предположение, что электрон также характеризуется корпускулярно-волновым дуализмом. Позднее это было подтверждено на опытах по дифракции на кристаллах. Де Бройль предложил уравнение, связывающее длину волны λ электрона или любой другой частицы с массой т и скоростью ν,
Волны частиц материи де Бройль назвал материальными волнами. Они свойственны всем частицам или телам. Однако, как следует из уравнения (5), для микротел длина волны настолько мала, что в настоящее время не может быть обнаружена. Так, для тела с массой 1000 кг, двигающегося со скоростью 108 км/ч (30 м/с)
В 1927 г. В. Гейзенберг (Германия) постулировал принцип неопределенности, согласно которому положение и импульс движения субатомной частицы (микрочастицы) принципиально невозможно определить в любой момент времени с абсолютной точностью. В каждый момент времени можно определить только лишь одно из этих свойств. Э. Шредингер (Австрия) в 1926 г. вывел математическое описание поведения электрона в атоме.
Работы Планка, Эйнштейна, Бора, де Бройля, Гейзенберга, а также Шредингера, предложившего волновое уравнение, заложили основу квантовой механики, изучающей движение и взаимодействие микрочастиц.
2.5. Квантово – механическая модель атома
В настоящее время строение атома рассматривается с позиций квантовой или волновой механики, в основе которой лежит представление о двойственной природе электрона: электрон, как и любая частица микромира, обладает одновременно свойствами частицы (массой m и скоростью передвижения v) и свойствами волны (длиной волны ):
где: h – постоянная Планка, наименьший квант энергии лучеиспускания.
Волновая механика описывает движение электрона в атоме как распространение волны по всему объему атома. Каждое мгновение электрон может находиться в любой части пространства вокруг ядра.
Путь, описываемый электроном, сливается в расплывчатое электронное облако, в котором плотность отрицательного заряда соответствует вероятности обнаружения электрона.
Плотность электронного облака максимальна на некотором расстоянии от ядра и характеризует удаленность электрона от ядра и запас его энергии. Состояние электрона в атоме математически описывается волновым уравнением.
Представление об электронном облаке – это квантово-механическая модель электрона в атоме. Понятию «электронное облако» соответствуют также понятия «атомная орбиталь», «квантовая ячейка», «энергетическая ячейка». Электронные облака (атомные орбитали) могут быть разного размера, различной формы, по-разному ориентированы в пространстве. Все это соответствует определенному энергетическому состоянию электрона.
В многоэлектронных атомах все электроны распределяются по энергетическим уровням (электронным слоям или электронным оболочкам). В пределах энергетического уровня электроны распределяются по подуровням (подоболочкам). Полная характеристика каждого электрона определяется значениями четырех квантовых чисел. Многоэлектронный атом подчиняется принципу Паули (1925 г.): в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел:
1. Главное квантовое число (n) характеризует энергетический уровень и отражает размеры электронного облака. n принимает значения целых чисел 1, 2, 3, 4, 5, 6, 7… (или в буквенном изображении K, L, M, N, O, P, Q…). С увеличением n (удалением электрона от ядра) энергия электрона возрастает. Число энергетических уровней в невозбужденном атоме равно номеру периода, в котором находится элемент в периодической системе. Например, электроны атома натрия распределяются по трем уровням, которым соответствуют значения главного квантового числа n=1 (K), n=2 (L), n=3 (M).
2. Орбитальное квантовое число l характеризует энергетический подуровень и отражает форму электронного облака. Усложнение формы электронного облака связано с возрастанием энергии электрона. Орбитальное квантовое число может изображаться буквами s, p, d, f или цифрами, которые в пределах данного энергетического уровня (с данным значением n) могут принимать целочисленные значения от 0 до (n-1).
Для обозначения подуровня указывают цифрой главное квантовое число (т.е. обозначают, в каком уровне находится электрон и каков размер его электронного облака) и буквой указывают орбитальное квантовое число (т.е. характеризуют форму этого облака). например, подуровни 1s, 2s, 2p, 4s, 3d, 5f и т.д.
Источник
Элементы квантовой механики
пространстве проявляются его волновые свойства ( интерференция , дифракция , поляризация ), ■ При взаимодействии с веществом – корпускулярные свойства (фотоэффект, эффект Комптона). Корпускула — частица ■ Эта двойственная природа света получила название корпускулярно-волнового дуализма . ■ Позже двойственная природа была открыта у электронов и других элементарных частиц.
Классическая физика не может дать наглядной модели сочетания волновых и корпускулярных свойств у микрообъектов. Движением микрообъектов управляют не законы классической механики Ньютона, а 2 законы квантовой механики . +4
Гипотеза де Бройля
□ Квантовые свойства света все более отчетливо проявляются с уменьшением длины волны λ , а при увеличении длины волны основную роль играют волновые свойства . □ Корпускулярные свойства обусловлены тем, что свет испускается фотонами , имеющими:
| 1) энергию | 2) импульс | 3) массу | |
где h=6,63∙10 -34 Дж∙с – постоянная Планка. □ Луи де Бройль в 1924 г. высказал гипотезу о том, что поскольку свет обладает двойственной природой, то и материальная частица должна обладать волновыми свойствами . □ Эта идея и получила название корпускулярно-волнового дуализма (в узком смысле). □ Каждой частице , обладающей импульсом р , должна соответствовать длина волны λ , связанная с импульсом р тем же соотношением, что и для фотона:
| формула де Бройля | |
| 3 | |
| +3 | |
Длина волны де Бройля λ
Если частица массой m 0 движется со скоростью υ
Источник
Гипотеза де бройля
В начале ХХ века было открыто двойственное поведение света, получившее название корпускулярно-волнового дуализма. В 1923 году Луи де Бройль предположил, что двойственная природа характерна и для движущихся частиц вещества, т.е. микрочастиц: электронов, протонов, нейтронов и т.д. По аналогии со светом частицам была сопоставлена длина волны
(13)
Здесь h — постоянная Планка, m и — масса и скорость частицы. Это выражение называется формулой де Бройля, а сами волны волнами де Бройля. Волновые свойства летящих электронов были обнаружены в опытах при изучении прохождения их через тонкие плёнки кристаллических веществ. Была получена чёткая дифракционная картина, позволившая рассчитать длину волны. Эти волны не являются электромагнитными или механическими волнами, распространяющимися в среде. Из оптико-механической аналогии было показано, что волны де Бройля являются волнами вероятности.
Корпускулярно-волновой дуализм
Ранее было показано, что интенсивность электромагнитной волны пропорциональна квадрату её амплитуды I ~ 


Принцип неопределённостей гейзенберга
Гейзенберг путём мысленного эксперимента открыл принцип неопределённости. Произведём мысленный эксперимент по нахождению электрона. Освещая электрон, можно оценить его положение с точностью x, не превышающей длины волны , вследствие дифракции света, т.е. x . Фотон, обладающий импульсом p = h/, передает электрону при соударении весь этот импульс или часть его. Следовательно, после соударения с электроном неопределённость его импульса р будет p h/. Произведение этих двух неопределённостей составляет xp h. После детального анализа Гейзенберг получил более точное неравенство xpх h/(2), где pх — неопределённость проекции импульса на координатную ось х. Аналогичные соотношения имеют место для координатных осей у и z. Поэтому можно записать
(13)
Здесь py и pz — неопределённость проекции импульса на координатную ось y и z соответственно. Это и есть математическая формулировка соотношений неопределённостей Гейзенберга, которые справедливы не только для электронов, но и для любых объектов. Этот принцип утверждает, что нельзя измерить одновременно с абсолютной точностью положение и импульс объекта. Чем точнее измеряется положение (x 0), тем больше неопределённость в измерении импульса (p ) и наоборот.
Для обычных размеров неопределённость не имела принципиального значения, так как постоянная Планка h очень мала. Однако когда переходили к описанию атома, размеры которого порядка 10 –10 м, то неопределённость нахождения координаты достигала размеров самого атома. Из этого вытекало, что понятие траектории движения электрона в атоме стало бессмысленным.
Корпускулярно-волновой дуализм частиц и соотношение неопределённости окончательно показали, что для описания атома и других микрообъектов должна быть создана новая теория, название которой уже было придумано — волновая или квантовая механика.
Источник
Двойственная природа электрона
а энергия фотона как волны может быть рассчитана по уравнению М. Планка, учитывающему частоту световой волны v:
где h — постоянная Планка, h = 6,626 • 10″ 34 Дж • с.
В 1924 г. Луи де Бройль, используя уравнения А. Эйнштейна и М. Планка, предположил наличие корпускулярно-волновой двойственности у электрона, что было отражено в уравнении де Бройля.
Поскольку корпускулярные свойства фотона выражены уравнением А. Эйнштейна, а волновые свойства — уравнением М. Планка, то из этих уравнений следует:
тс = ——-, где v =
1 =
Х =
где v — скорость движения любой микрочастицы; X — длина световой волны.
Поскольку произведение массы тела со скоростью его движения Р = mv называется импульсом частицы Р, то уравнение де Бройля можно записать в следующем виде:
Двойственная природа электрона в 1927 г. была подтверждена экспериментально учеными США, Англии и СССР независимо друг от друга. Было обнаружено, что электроны обладают не только массой и зарядом, но также дифракцией и интерференцией.
В 1926 г. Э. Шредингер предположил, что состояние электрона в атоме описывается уравнением стоячей электромагнитной волны, и получил уравнение, связывающее энергию электрона с его волновым движением, с пространственными координатами волновой функции \|/, которая соответствует амплитуде трехмерного волнового процесса. В квантово-механической форме волновое уравнение Шредингера для атома водорода имеет вид
В Химия. Учеб. пособие
СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник