Двойственная природа электрона
Подтвержденная экспериментально в 1927 г. двойственная природа электрона, обладающего свойствами не только частицы, но и волны, побудила ученых к созданию новой теории строения атома, учитывающей оба этих свойства. Современная теория строения атома опирается на квантовую механику.
Двойственность свойств электрона проявляется в том, что он, с одной стороны, обладает свойствами частицы (имеет определенную массу покоя), а с другой — его движение напоминает волну и может быть описано определенной амплитудой, длиной волны, частотой колебаний и др. Поэтому нельзя говорить о какой-либо определенной траектории движения электрона — можно лишь судить о той или иной степени вероятности его нахождения в данной точке пространства.
Следовательно, под электронной орбитой следует понимать не определенную линию перемещения электрона, а некоторую часть пространства вокруг ядра, в пределах которого вероятность пребывания электрона наибольшая. Иными словами электронная орбита не характеризует последовательность перемещения электрона от точки к точке, а определяется вероятностью нахождения электрона на определенном расстоянии от ядра.
ψ — волновая функция (аналог амплитуды для волнового движения в классической механике), которая характеризует движение электрона в пространстве как волнообразное возмущение
Электро́нная пло́тность — плотность вероятности обнаружения электрона в данной точке пространства.
Рассмотрим водородоподобный атом — систему из двух зарядов: положительно заряженного тяжёлого ядра, окруженного симметричной сферой отрицательного электричества — электроном, вероятность обнаружения которого распределена сферически симметрично вокруг ядра; изображается в виде облака. Таким образом, у атома водорода (и ему подобных) в основном состоянии электронная плотность зависит только от расстояния до ядра и одинакова в любой точке сферы. Это состояние электрона характеризуется нулевым орбитальным моментом импульса (так называемое s-состояние). В возбуждённых состояниях с отличным от нуля орбитальным моментом электрона (p-, d-, f-. состояния) сферическая симметрия электронной плотности отсутствует.
характеристика состояния электрона системой квантовых чисел
Квантовые числа – целые или дробные числа, определяющие возможные значения физических величин, характеризующих квантовую систему (молекулу, атом, атомное ядро, элементарную частицу). Квантовые числа отражают дискретность (квантованность) физических величин, характеризующих микросистему. Набор квантовых чисел, исчерпывающе описывающих микросистему, называют полным
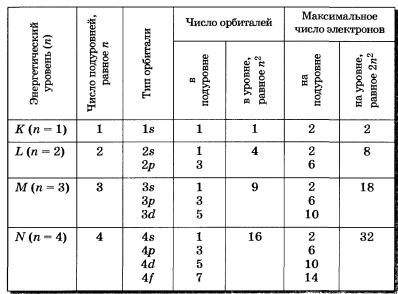
- Главное квaнтовое число n (рано номеру периода элемента) определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .)
- Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n-1 (l = 0, 1, 2, 3. n-1).Каждому значению l соответствует орбиталь особой формы. Орбитали с l = 0 называются s-орбиталями, l = 1 – р-орбиталями (3 типа, отличающихся магнитным квантовым числом m), l = 2 – d-орбиталями (5 типов), l = 3 – f-орбиталями (7 типов).
- Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Его значения изменяются от +lдо —l, включая 0. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО: рx, рy, рz.
- Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2.Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином (от англ. веретено). Для обозначения электронов с различными спинами используются символы:
и
.
ногоэлектронных атомов. Принцип наименьшей энергии. Принцип Паули. Правило Хунда. Правило Клечковского. Электронные и электронно-графические формулы атомов элементов в основном и возбужденном состоянии.
Максимальное число электронов на энергетическом уровне определяется как 2n 2 , а на подуровне – как 2(2l+1)
Число электронов, которые могут находиться на одном энергетическом уровне, определяется формулой 2n2, где n – номер уровня. Максимальное заполнение первых четырех энергетических уровней: для первого уровня – 2 электрона, для второго – 8, для третьего – 18, для четвертого – 32 электрона. Максимально возможное заполнение электронами более высоких энергетических уровней, в атомах известных элементов не достигнуто. Квантово-механические расчеты показывают, что в многоэлектронных энергия электронов одного уровня неодинакова; электроны заполняют атомные орбитали разных видов и имеют разную энергию. Каждый энергетический уровень, кроме первого, расщепляется на такое число энергетических подуровней, сколько видов орбиталей включает этот уровень. Второй энергетический уровень расщепляется на два подуровня (2s – и 2p-подуровни), третий энергетический уровень – на три подуровня (3s-, 3p- и 3d-подуровни). Каждый s-подуровень содержит одну s орбиталь, каждый р-подуровень – три р-орбитали, каждый d-подуровень семь f-орбиталей. Закономерность заполнения электронных оболочек атомов определяется принципом запрета, установленным в 1925 г швейцарским физиком Паули
(принцип Паули): В атоме не могут одновременно находиться два электрона с одинаковым набором четырех квантовых квантовых чисел (заполнение электронами орбиталей происходит следующим образом: сначала на каждой орбитали располагается по одному электрону, затем, после заполнения всех орбиталей происходит распределение вторых электронов с противоположным спином).
Используя понятия квантовые числа можно сказать, что: Каждый электрон в атоме однозначно характеризуется своим набором четырех квантовых чисел — главного n, орбитальногоl, магнитного ml, и спинового ms. Заселение электронами энергетических уровней, подуровней и атомных орбиталей подчиняется следующему правилу:
В невозбужденном атоме все электроны обладают наименьшей энергией (принцип наименьшей энергии). Это означает, что каждый из электронов, заполняющих оболочку атома, занимает такую орбиталь, чтобы атом в целом имел минимальную энергию. Последовательно квантовое возрастание энергии подуровней происходит в следующем порядке: 1s — 2s -2р — 3s – 3р — 4s –3d — 4р — 5s -…. Такой порядок увеличения энергии подуровней определяет расположение эле Ментов в Периодической системе. Заполнение атомных орбиталей внутри одного энергетического подуровня происходит в соответствии с правилом, сформулированным немецким физиком Ф. Хундом (1927г)
(правило Хунда): При данном значении квантового числа l (т.е. в пределах одного подуровня) в основном состоянии электроны располагаются таким образом, что значение суммарного спина атома максимально. Это означает, что на подуровне должно быть максимально возможное число неспаренных электронов. Порядок возрастания энергии атомной орбитали в сложных атомах описывается
правилом Клечковского: энергия атомной орбитали возрастает в соответствии с увеличением n +l главного и орбитального квантовых чисел. При одинаковом значении суммы энергия меньше у атомной орбитали с меньшим значением главного квантового числа.
Распределение электронов по различным атомным орбиталям называют электронной конфигурацией атома. Электронная конфигурация с наименьшей энергией соответствует основному состоянию атома, остальные конфигурации относятся к возбужденным состояниям. Электронную конфигурацию атома изображают двумя способами – в виде электронных формул и электронно-графических диаграмм. При написании электронных формул используют главное и орбитальное квантовые числа. Подуровень обозначают с помощью главного квантового числа (цифрой) и орбитального квантового числа (соответствующей буквой). Число электронов на подуровне характеризует верхний индекс. Например. Для основного состоянии атома водорода электронная формула: 1s1. Более полно строение электронных подуровней можно описать с помощью электронографических диаграмм, где распределение электронов по подуровням представляют в виде квантовых ячеек. Орбиталь в этом случае принято условно изображать квадратом, около которого проставлено обозначение подуровня. Подуровни на каждом уровне должны быть немного смещены по высоте, так как их энергия несколько различается. Электроны обозначают стрелками или ¯ в зависимости от знака спинового квантового числа. С учетом структуры электронных конфигураций атомов все известные элементы в соответствии со значением орбитального квантового числа последнего заполняемого подуровня можно разбить на четыре группы: s –элементы, р-элементы, d-элементы, f-элементы.
Источник
Двойственная природа электрона
Подтвержденная экспериментально в 1927 г. двойственная природа электрона, обладающего свойствами не только частицы, но и волны, побудила ученых к созданию новой теории строения атома, учитывающей оба этих свойства. Современная теория строения атома опирается на квантовую механику.
Двойственность свойств электрона проявляется в том, что он, с одной стороны, обладает свойствами частицы (имеет определенную массу покоя), а с другой — его движение напоминает волну и может быть описано определенной амплитудой, длиной волны, частотой колебаний и др. Поэтому нельзя говорить о какой-либо определенной траектории движения электрона — можно лишь судить о той или иной степени вероятности его нахождения в данной точке пространства.
Следовательно, под электронной орбитой следует понимать не определенную линию перемещения электрона, а некоторую часть пространства вокруг ядра, в пределах которого вероятность пребывания электрона наибольшая. Иными словами электронная орбита не характеризует последовательность перемещения электрона от точки к точке, а определяется вероятностью нахождения электрона на определенном расстоянии от ядра.
Характеристика энергетического состояния электрона с использованием квантовых чисел.
Характер движения электрона в атоме определяется четырьмя числами – n, l, m, s, получивших название квантовых.
Главное квантовое число n— это число может принимать любые целочисленные значения: n=1,2,3… Определяет орбитальный радиус и соответствующий главный энергетический уровень.
Орбитальное квантовое число l — это число, которое может принимать целочисленные значения l = n-1.орбитальное квантовое число определяет форму атомной орбитали и орбитальный подуровень энергии главного энергетического уровня атома при данном n.
При l=0, форма орбитали сферическаяи называется s-орбиталью. При l=1 форма орбитали имеет вид песочных часов и называется p-орбиталью.
Магнитное квантовое число m – принимает целочисленные значения ±l. Эти значения определяют ориентацию орбиталей в пространстве, их число на данном орбитальном подуровне и магнитный энергетический подуровень.
Спиновое квантовое число s – принимает два значения: ±1/2. Характеризует собственное вращательное движение.
Орбиталь и соответствующий энергетический уровень, определяемый четырьмя квантовыми числами, называют квантовым состоянием электрона в атоме.
Конфигурацию электронной оболочки атома можно определить путем заполнения квантовых состояний иона на основе принципов или правил заполнения(Паули). При построениии электронной конфигурации удобно любую орбиталь и соответствующий ей уровень изображать с помощью квадрата. Это квантовая ячейка. Принцип минимума энергии: электроны в возбужденном атоме распространяются по квантовым состояниям таким образом, чтобы суммарная энергия атома была минимальна. Принцип Паули: на одной атомной орбитали (в одной квантовой ячейке) не может быть более двух электронов.
П 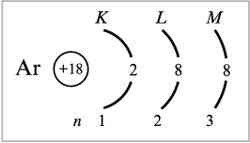
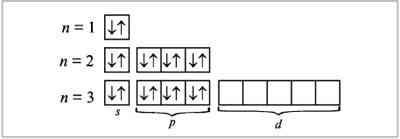
по квантовым уровням и подуровням
х имической связью называют совокупность взаимодействий между электронами и ядрами, приводящих к соединению атомов в молекулу.
Ионная связь — прочная химическая связь, образующаяся между атомами с большой разностью (>1,7 по шкале Полинга) электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью.Это притяжение ионов как разноименно заряженных тел. Примером может служить соединение CsF. Между ионами Na+ и Cl- возникают силы электростатического притяжения, в результате чего образуется соединение. Ионная связь — крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу. Образуются ионы.
Источник
 и
и  .
.