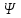Квантовые числа и двойственная природа электрона
1) «Кусочки материи».
Демокрит полагал, что свойства того или иного вещества определяются формой, массой, пр. характеристиками образующих его атомов: у огня атомы остры, поэтому огонь способен обжигать, у твёрдых тел они шероховаты, поэтому накрепко сцепляются друг с дружкой, у воды — гладки, поэтому она способна течь. Даже душа человека, согласно Демокриту, состоит из атомов.
2) «Пудинг с изюминками» (модель Дж. Томсона).
Дж. Дж. Томсон предложил рассматривать атом как некоторое положительно заряженное тело с заключёнными внутри него электронами. Эта модель не объясняет сериальный характер излучения атома.
3) Атом, «типа Сатурна». 1904 год. Хентара Нагаока. Маленькое положительное ядро, вокруг которого, по орбиталям, вращаются электроны.
4) «Планетарная модель атома». 1911 год. Эрнест Резерфорд, проделав ряд экспериментов, пришёл к выводу, что атом представляет собой скорее некоторое подобие планетной системы, то есть что электроны движутся вокруг положительно заряженного тяжёлого ядра, расположенного в центре атома. Для объяснения стабильности атомов Нильсу Бору пришлось ввести постулаты, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических состояниях, не излучает. Постулаты Бора показали, что для описания атома классическая механика неприменима. Дальнейшее изучение излучения атома привело к созданию квантовой механики, которая позволила объяснить подавляющее большинство наблюдаемых фактов.
Квантовые числа и двойственная природа электрона
Квантовые числа — энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
1. Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3. )
2. Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n -1(l = 0, 1, 2, 3. n -1). Каждому значению l соответствует орбиталь особой формы. Орбитали с l = 0 называются s -орбиталями,
l = 1 – р -орбиталями (3 типа, отличающихся магнитным квантовым числом m),
l = 2 – d -орбиталями (5 типов),
l = 3 – f -орбиталями (7 типов).
3. Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Его значения изменяются от + l до — l, включая 0. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р -АО: р x, р y, р z.
4. Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином (от англ. веретено). Для обозначения электронов с различными спинами используются символы: и .
5. Отчетливо проявляющаяся двойственная природа электрона не позволяет его рассматривать как обычную (классическую) частицу.
6. С двойственной природой электрона связано соотношение неопределенностей, в соответствии с которым невозможно одновременно точно измерить и координаты, и импульс (mv) этой частицы. Если электрон локализован в небольшой области около ядра, неопределенность его положения мала, но в этом случае велика неопределенность импульса, что означает большую кинетическую энергию электрона.
В чем заключается двойственная природа электрона.
7. Представления о стационарных состояниях атома и двойственной природе электрона, а также требования принципа неопределенности были использованы австрийским физиком Эрви-ном Шредингером, который в 1926 г. предложил модель, описывающую электрон в атоме как своего рода стоячую волну, причем вместо точного положения электрона в пространстве рассматривалась вероятность его пребывания в определенном месте.
8. Атомы химического элемента не имеют строго Определенных размеров, что обусловлено двойственной природой электронов. Пользуются эффективными или кажущимися радиусами шарообразных атомов, сближенных при образовании кристаллов.
9. В последнее время в электронной теории химической связи были выдвинуты новые идеи на основе квантово-механических воззрений, вытекающих из положения современной физики о двойственной природе электрона, в единстве сочетающего свойства микрочастицы и волны. По этим воззрениям движение электронов может быть рассмотрено с учетом принципа вероятности и описано уравнениями волновой механики.
10. В последнее время в электронной теории химической связи были выдвинуты новые идеи на основе квантово-механических воззрений, вытекающих из положения современной физики о двойственной природе электрона, в единстве сочетающего свойства микрочастицы и волны, По этим воззрениям движение электронов может быть рассмотрено с учетом принципа вероятности и описано уравнениями волновой механики.
11. Двойственная природа электрона — корпускулярная и волновая — не совместима с понятиями классической механики, которая представляет электрон как точечную частицу, описывающую вполне определенную траекторию со скоростью, известной в каждый момент времени.
12. Подобно тому как для объяснения всех свойств света необходимо привлекать как волновую, так и корпускулярную модели, точно так же электроны и ядра атомов приходится рассматривать и как электрически заряженные частицы, и как волны. Математическим выражением двойственной природы электронов, находящихся в атомах и молекулах, является волновое уравнение Шредингера. Решая это дифференциальное уравнение для какой-либо системы, можно получить значения энергии различных возможных состояний, или уровни энергии, на которых может находиться система. Поглощение атомом или молекулой кванта света может произойти только в том случае, если величина кванта точно равна разности энергий двух состояний, возможных для системы.
13. Необходимо исправить прежнюю механику с учетом двойственной природы электрона. Электронная волна с течением времени распространяется причинно, по законам распространения волн, но положение электрона как частицы нельзя предсказать точно, можно только указать вероятность того или иного положения. Чем плотнее в данном месте электронная волна, тем выше вероятность обнаружить там электрон.
14. Гейзенбергом был предложен принцип неопределенности, который позволяет учесть двойственную природу электрона при описании его поведения.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник
Корпускулярно-волновые свойства частиц
Характеристика состояния электронов в атоме основана на положении квантовой механики о двойственной природе электрона, обладающего одновременно свойствами частицы и волны.
Впервые двойственная корпускулярно-волновая природа была установлена для света. Исследования ряда явлений (излучение раскаленных тел, фотоэффект, атомные спектры) привели к выводу, что энергия испускается и поглощается не непрерывно, а дискретно, отдельными порциями (квантами). Предположение о квантовании энергии впервые было высказано Максом Планком (1900 г.) и обосновано Альбертом Эйнштейном (1905 г.): энергия кванта (∆Е) зависит от частоты излучения (ν):
∆Е = hν, где h = 6,63·10 -34 Дж·с – постоянная Планка.
Приравнивая энергию фотона hν к полному запасу его энергии mс 2 и, учитывая, что ν=с/λ, получаем соотношение выражающее взаимосвязь волновых и корпускулярных свойств фотона:
(54)
В 1924 году Луи де Бройль предположил, что двойственная корпускулярно-волновая природа присуща не только излучению, но и любой материальной частице: каждой частице, имеющей массу(m) и движущейся со скоростью (υ) соответствует волновой процесс с длиной волны λ:
Чем меньше масса частицы, тем больше длина волны. Поэтому обнаружить волновые свойства у макрочастиц трудно.
В 1927 г. Американские ученые Девиссон и Джермер, англичанин Томсон и советский ученый Тартаковский независимо друг от друга обнаружили дифракцию электронов, что явилось экспериментальным подтверждением волновых свойств электронов. Позднее была открыта дифракция (интерференция) α-частиц, нейтронов, протонов, атомов и даже молекул. В настоящее время дифракция электронов используется для исследования строения вещества.
В волновых свойствах элементарных частиц заложен один из принципов волновой механики: принцип неопределенности (В. Гейзенберг 1925 г.): для малых тел атомного масштаба невозможно одновременно точно определить положение частицы в пространстве и ее скорость (импульс). Сем точнее определены координаты частицы, тем менее определенной становится ее скорость, и наоборот. Соотношение неопределенностей имеет вид:



где ∆х – неопределенность положения частицы, ∆Рх – неопределенность величины импульса или скорости в направлении х. Аналогичные соотношения записываются и для координат y и z. Величина ℏ, входящая в соотношение неопределенности, очень мала, поэтому для макрочастиц неопределенности в значениях координат и импульсов ничтожны.
Следовательно, нельзя рассчитать траекторию движения электрона в поле ядра, можно лишь оценить вероятность его нахождения в атоме с помощью волновой функции ψ, которая заменяет классическое понятие траектории. Волновая функция ψ характеризует амплитуду волны в зависимости от координат электрона, а ее квадрат ψ 2 определяет пространственное распределение электрона в атоме. В наиболее простом варианте волновая функция зависит от трех пространственных координат и дает возможность определить вероятность нахождения электрона в атомном пространстве или его орбиталь. Таким образом, атомная орбиталь (АО) – область атомного пространства, в котором вероятность нахождения электрона наибольшая.
Волновые функции получаются при решении основополагающего соотношения волновой механики – уравнения Шредингера (1926 г):
(57)
где h- постоянная Планка, — переменная величина, U – потенциальная энергия частицы, Е – полная энергия частицы, x, y,z, — координаты.
Таким образом, квантование энергии микросистемы вытекает непосредственно из решения волнового уравнения. Волновая функция полностью характеризует состояние электрона.
Волновая функция системы – это функция состояния системы, квадрат которой равен плотности вероятности нахождения электронов в каждой точке пространства. Она должна удовлетворять стандартным условиям: быть непрерывной, конечной, однозначной, обращаться в нуль там, где электрон отсутствует.
Точное решение получается для атома водорода или водородоподобных ионов, для многоэлектронных систем используются различные приближения. Поверхность, ограничивающая 90–95 % вероятности нахождения электрона или электронной плотности, называют граничной. Атомная орбиталь и плотность электронного облака имеют одинаковую граничную поверхность (форму) и одинаковую пространственную ориентацию. Атомные орбитали электрона, их энергия и направление в пространстве зависят от четырех параметров – квантовых чисел:главного, орбитального, магнитного и спинового. Первые три характеризуют движение электрона в пространстве, а четвертое – вокруг собственной оси.
Квантовое число n – главное. Оно определяет энергетический уровень электрона в атоме, удаленность уровня от ядра и размер электронного облака. Принимает целые значения от 1 до ∞ и соответствует номеру периода. Из периодической системы для любого элемента по номеру периода можно определить число энергетических уровней атома, и какой энергетический уровень является внешним. Чем больше n, тем больше энергия взаимодействия электрона с ядром. При n = 1 атом водорода находится в основном состоянии, при n> 1 – в возбужденном. Если n ∞, то электрон покинул атомный объем. Произошла ионизация атома.
Источник