- Урок по химии «Электронная природа химических связей в органических соединениях» (10 класс)
- Электронные представления о природе химической связи
- Электронная структура Схема основного электронного состояния
- 2. Природа и типы химических связей
- Электронные представления о природе химической связи
- Электронная структура Схема основного электронного состояния
Урок по химии «Электронная природа химических связей в органических соединениях» (10 класс)
Подвести учащихся к пониманию, осознанию электронной природы химической связи в органических соединениях.
Ø Развивающая
Развить абстрактное мышление, познавательную активность, умение работать с таблицами, шаростержневыми моделями, анализировать, делать выводы, умение выделить главное.
Ø Воспитательная
Воспитать уверенность к себе, самостоятельность, аккуратность, внимательность, культуру труда, любовь к выбранной профессии.
1) Электронное облако и орбиталь.
1) Строение атома углерода.
2) Строение молекулы СН4 (метана).
3) Образование SP 3 – гибридизация;
образование SP 2 – гибридизация;
образование SP – гибридизация.
7) Мультимедийный проектор.
— S , P , гибридных орбиталей.
Тип урока: урок изучения нового материала.
Вид урока: комбинированный.
2. Определение задач урока, актуализация ранее усвоенных знаний.
4. Изучение учебного материала.
5. Упражнения по закреплению и совершенствованию знаний.
6. Контроль знаний и умений.
1. Организационный момент (тема, число – на доске, цель урока).
2. Актуализация ранее усвоенных знаний:
1. Что понимают под состоянием электронов в атоме?
— это совокупность информации об энергии определенного
электрона (ē) и пространстве, в котором он находится.
2. Что называют электронным облаком или орбиталью?
— это пространство вокруг ядра атома, в котором наиболее вероятно пребывание ē.
3. О какой степени вероятности можно говорить в данном случае?
4. Какие первых два типа орбиталей вам известны?
5. Какую форму имеют эти орбитали?
— S – форму шара (круга) – (показывают трафареты);
— P – форму правильной гантели.
б) объяснение нового материала:
1. строение атома углерода 2-х и 4-х валентных;
2. электронно-графические формулы.
Все органические вещества содержат углерод. В молекулах органических веществ атом углерода переходит в возбужденное состояние (показываю на экране).
3. Вы уже знаете, что атом углерода содержит на внешнем уровне четыре валентных электрона:
1 электрон на S – орбитали сферической формы
3 электрона на трех P – орбиталях, орбитали имеют форму гантели и расположены под углом 90º.
Таким образом, можно предположить, что в молекуле метана CH 4 атом углерода не может образовать 4 одинаковых связи с четырьмя атомами водорода (1 атом водорода имеет 1 электрон на S – орбитали сферической формы). Однако экспериментально доказано, что в молекуле метана все связи С – Н равноценны и направлены к вершинам правильного тетраэдра под углом 109˚28`.
В 1931 г. американский учёный Л. Полинг доказал, что в молекуле метана в момент образования молекулы электронные облака смешиваются и образуют гибридные электронные облака, происходит процесс гибридизации.
Гибридизация – процесс смешения разных, но близких по энергии, орбиталей данного атома, с возникновением того же числа новых гибридных орбиталей, одинаковых по форме и энергии.
4. В зависимости от числа вступивших в гибридизацию орбиталей атом углерода может находиться в одном из трёх состояний гибридизации: sp 3 , sp 2 , sp .
sp 3 – гибридизация: происходит смешение одной S и трёх P орбиталей. Образуются четыре одинаковые гибридные орбитали, расположенные относительно друг друга под тетраэдрическим углом 109˚28`. Образуются 4 ковалентные σ – связи.
Объяснение Характерен для алканов.
рис. Строение молекулы метана СН4 (тетраэдрическое)
sp 2 – гибридизация: происходит смешение одной S и двух P орбиталей. Образуются три одинаковые гибридные орбитали, они расположены относительно друг друга под углом 120˚, лежат в одной плоскости и стремятся к вершинам треугольника. Образуются 3 ковалентные δ – связи.
Объяснение Характерен для алканов.
Оставшаяся одна негибридизованная орбиталь расположена перпендикулярно плоскости образования δ – связей и участвует в образовании — связи.
рис. Строение молекулы этилена С2Н4 (плоское тригональное)
sp – гибридизация: происходит смешение одной S и одной P орбитали. Образуются две одинаковые гибридные орбитали, они расположены относительно друг друга под углом 180˚, лежат на одной линии. Образуются 2 ковалентные δ – связи.
Объяснение Характерен для алканов.
Оставшиеся две негибридизованные орбитали расположены во взаимно перпендикулярных плоскостях и образуют две — связи.
рис. Строение молекулы ацетилена С2Н2 (линейное)
Направленность гибридных орбиталей в пространстве , а следовательно, и геометрическое строение молекул зависят от типа гибридизации. На форму молекулы в пространстве влияет направленность только σ – связей.
5. Упражнение по закреплению и совершенствованию знаний.
1. В предложенных органических соединениях у каждого атома С определите:
б) количество δ (сигма) и (пи) связей.
2. Какие формы в пространстве имеют перечисленные ниже молекулы, какая их геометрия?
6. Контроль знаний, умений, навыков.
— повторить понятия «гомологи», «изомеры».
Источник
Электронные представления о природе химической связи
В органических соединениях преобладающим типом связи является ковалентная связь, образующаяся чаще всего между атомами, имеющими неспаренные электроны. Количество неспаренных электронов у атома можно определить, используя понятия квантовой химии. Электрон обладает двойственной природой: он может проявлять свойства частицы и свойства волны. При движении вокруг ядра атома каждый электрон создает электронное облако, определенным образом распределенное в пространстве. Пространство, занимаемое электронным облаком, называется атомной орбиталью. Каждое устойчивое положение электрона определяется четырьмя квантовыми числами:
- Главное квантовое число n- показывает уровень энергии электронов, который определяется расстоянием электрона от ядра;
- Побочное (орбитальное) квантовое число l характеризуется моментом количества движения электрона относительно ядра и определяет форму атомной орбитали. В зависимости от числа l, принимающего значения до n-1, то есть 0,1,2,3, различают s, p, d, f-подуровни. Для s-подуровня (L=0) электронное облако имеет сферическую форму, для р-подуровня (L=1) – форму гантелей, d и f-орбитали (L=2, 3) имеют похожую, но более сложную форму.
- Магнитное квантовое число ml характеризует ориентацию орбитали по отношению к внешнему магнитному полю.S-орбиталь имеет центр симметрии и может иметь только одну ориентацию.
Р-орбиталь имеет ось симметрии, может располагаться в трех взаимно перпендикулярных плоскостях.
- Спиновое квантовое число msхарактеризуется моментом количества вращения электрона вокруг собственной оси. Так как электрон может вращаться только в двух направлениях – по и против часовой стрелки, спин имеет два значения. В одной орбитали могут размещаться два электрона с противоположными спинами.
Если атомная орбиталь содержит один (неспаренный) электрон, такое состояние неустойчиво, так как у атома имеется нескомпенсированный магнитный (спиновый) момент и он стремится обобщить свой неспаренный электрон с неспаренным электроном другого атома.
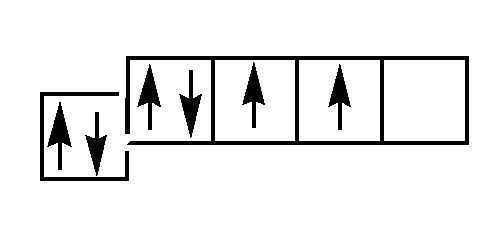
Количество неспаренных электронов может увеличиваться в результате возбуждения атома. Возбуждение возможно при получении кванта энергии и при наличии незаполненной орбитали на внешнем энергетическом подуровне, при этом один из спаренных электронов переходит на ближайший подуровень, например, с s-подуровня на р-подуровень или с р-подуровня на d-подуровень. Углерод имеет 6 электронов со следующим их распределением по энергетичесским уровням и подуровням:
Электронная структура Схема основного электронного состояния
ри возбуждении происходит переход электрона на внешней электронной оболочке со 2-го s-подуровня на свободную р-орбиталь.
Схема возбужденного электронного состояния
Такой возбужденный углерод может образовывать 4 равноценные ковалентные связи.
Источник
2. Природа и типы химических связей
Атомы большинства химических элементов не могут существовать в изолированном состоянии. Они соединяются между собой и образуют молекулы или кристаллы (атомные, металлические, ионные).
Химическая связь — это электростатическое взаимодействие атомов, в результате которого они объединяются в более сложные комплексы (ионы, радикалы, молекулы, кристаллы).
Образование химической связи происходит самопроизвольно, и при этом всегда наблюдается выделение энергии. Это значит, что полная энергия образовавшейся системы меньше, чем общая энергия отдельных атомов. Стремление системы к минимуму энергии является главной причиной возникновения химической связи между атомами.
В образовании химической связи, как правило, участвуют электроны, расположенные на наружном энергетическом уровне и слабо связанные с ядром.
Благородные газы не образуют химических связей. Они существуют в виде изолированных атомов (одноатомных молекул). Наличие химической инертности благородных газов, отличающихся от других атомов заполненным внешним энергетическим уровнем, позволило учёным прийти к выводу, что при образовании химических связей атомы стремятся к завершению своего внешнего электронного уровня.
В основе химической связи всегда лежит электростатическое взаимодействие заряженных частиц — ядер и электронов. Образование химической связи связано с перекрыванием электронных орбиталей и перераспределением электронной плотности между взаимодействующими атомами.
В зависимости от разности электроотрицательностей связанных атомов возможно возникновение трёх типов химической связи: ковалентной , ионной и металлической .
Ковалентная связь возникает между атомами неметаллов, т. е. между атомами с высокой электроотрицательностью. При взаимодействии одинаковых атомов неметаллов (\(χ\) больше \(2\), и электроотрицательности примерно равны) образуется ковалентная неполярная связь. Если взаимодействуют атомы, для которых разность \(χ\) от \(0,4\) до \(2\), то образуется ковалентная полярная связь.
Ионная связь возникает между атомами металлов и неметаллов, электроотрицательности которых различаются значительно (разность \(χ\) больше \(2\)).
Источник
Электронные представления о природе химической связи
В органических соединениях преобладающим типом связи является ковалентная связь, образующаяся чаще всего между атомами, имеющими неспаренные электроны. Количество неспаренных электронов у атома можно определить, используя понятия квантовой химии. Электрон обладает двойственной природой: он может проявлять свойства частицы и свойства волны. При движении вокруг ядра атома каждый электрон создает электронное облако, определенным образом распределенное в пространстве. Пространство, занимаемое электронным облаком, называется атомной орбиталью. Каждое устойчивое положение электрона определяется четырьмя квантовыми числами:
- Главное квантовое число n- показывает уровень энергии электронов, который определяется расстоянием электрона от ядра;
- Побочное (орбитальное) квантовое число l характеризуется моментом количества движения электрона относительно ядра и определяет форму атомной орбитали. В зависимости от числа l, принимающего значения до n-1, то есть 0,1,2,3, различают s, p, d, f-подуровни. Для s-подуровня (L=0) электронное облако имеет сферическую форму, для р-подуровня (L=1) – форму гантелей, d и f-орбитали (L=2, 3) имеют похожую, но более сложную форму.
- Магнитное квантовое число ml характеризует ориентацию орбитали по отношению к внешнему магнитному полю.S-орбиталь имеет центр симметрии и может иметь только одну ориентацию.
Р-орбиталь имеет ось симметрии, может располагаться в трех взаимно перпендикулярных плоскостях.
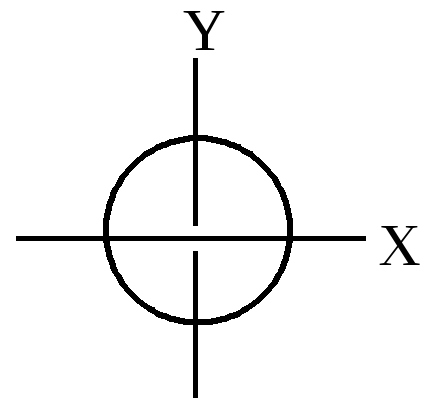 | 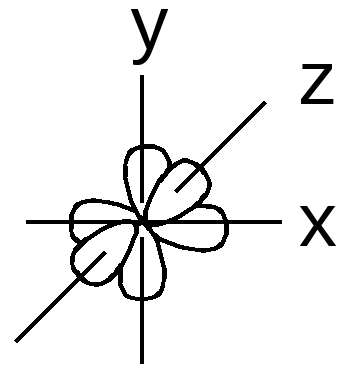 |
| s-орбиталь | p-орбиталь |
Рисунок 1
- Спиновое квантовое число msхарактеризуется моментом количества вращения электрона вокруг собственной оси. Так как электрон может вращаться только в двух направлениях – по и против часовой стрелки, спин имеет два значения. В одной орбитали могут размещаться два электрона с противоположными спинами.
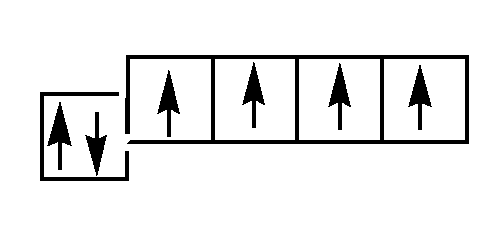
Если атомная орбиталь содержит один (неспаренный) электрон, такое состояние неустойчиво, так как у атома имеется нескомпенсированный магнитный (спиновый) момент и он стремится обобщить свой неспаренный электрон с неспаренным электроном другого атома. Количество неспаренных электронов может увеличиваться в результате возбуждения атома. Возбуждение возможно при получении кванта энергии и при наличии незаполненной орбитали на внешнем энергетическом подуровне, при этом один из спаренных электронов переходит на ближайший подуровень, например, с s-подуровня на р-подуровень или с р-подуровня на d-подуровень. Углерод имеет 6 электронов со следующим их распределением по энергетичесским уровням и подуровням: 
Электронная структура Схема основного электронного состояния
П С* 1s 2 2s 1 2p 3 ри возбуждении происходит переход электрона на внешней электронной оболочке со 2-го s-подуровня на свободную р-орбиталь. Схема возбужденного электронного состояния Такой возбужденный углерод может образовывать 4 равноценные ковалентные связи.
Источник