Урок по химии «Электронная природа химических связей в органических соединениях» (10 класс)
Подвести учащихся к пониманию, осознанию электронной природы химической связи в органических соединениях.
Ø Развивающая
Развить абстрактное мышление, познавательную активность, умение работать с таблицами, шаростержневыми моделями, анализировать, делать выводы, умение выделить главное.
Ø Воспитательная
Воспитать уверенность к себе, самостоятельность, аккуратность, внимательность, культуру труда, любовь к выбранной профессии.
1) Электронное облако и орбиталь.
1) Строение атома углерода.
2) Строение молекулы СН4 (метана).
3) Образование SP 3 – гибридизация;
образование SP 2 – гибридизация;
образование SP – гибридизация.
7) Мультимедийный проектор.
— S , P , гибридных орбиталей.
Тип урока: урок изучения нового материала.
Вид урока: комбинированный.
2. Определение задач урока, актуализация ранее усвоенных знаний.
4. Изучение учебного материала.
5. Упражнения по закреплению и совершенствованию знаний.
6. Контроль знаний и умений.
1. Организационный момент (тема, число – на доске, цель урока).
2. Актуализация ранее усвоенных знаний:
1. Что понимают под состоянием электронов в атоме?
— это совокупность информации об энергии определенного
электрона (ē) и пространстве, в котором он находится.
2. Что называют электронным облаком или орбиталью?
— это пространство вокруг ядра атома, в котором наиболее вероятно пребывание ē.
3. О какой степени вероятности можно говорить в данном случае?
4. Какие первых два типа орбиталей вам известны?
5. Какую форму имеют эти орбитали?
— S – форму шара (круга) – (показывают трафареты);
— P – форму правильной гантели.
б) объяснение нового материала:
1. строение атома углерода 2-х и 4-х валентных;
2. электронно-графические формулы.
Все органические вещества содержат углерод. В молекулах органических веществ атом углерода переходит в возбужденное состояние (показываю на экране).
3. Вы уже знаете, что атом углерода содержит на внешнем уровне четыре валентных электрона:
1 электрон на S – орбитали сферической формы
3 электрона на трех P – орбиталях, орбитали имеют форму гантели и расположены под углом 90º.
Таким образом, можно предположить, что в молекуле метана CH 4 атом углерода не может образовать 4 одинаковых связи с четырьмя атомами водорода (1 атом водорода имеет 1 электрон на S – орбитали сферической формы). Однако экспериментально доказано, что в молекуле метана все связи С – Н равноценны и направлены к вершинам правильного тетраэдра под углом 109˚28`.
В 1931 г. американский учёный Л. Полинг доказал, что в молекуле метана в момент образования молекулы электронные облака смешиваются и образуют гибридные электронные облака, происходит процесс гибридизации.
Гибридизация – процесс смешения разных, но близких по энергии, орбиталей данного атома, с возникновением того же числа новых гибридных орбиталей, одинаковых по форме и энергии.
4. В зависимости от числа вступивших в гибридизацию орбиталей атом углерода может находиться в одном из трёх состояний гибридизации: sp 3 , sp 2 , sp .
sp 3 – гибридизация: происходит смешение одной S и трёх P орбиталей. Образуются четыре одинаковые гибридные орбитали, расположенные относительно друг друга под тетраэдрическим углом 109˚28`. Образуются 4 ковалентные σ – связи.
Объяснение Характерен для алканов.
рис. Строение молекулы метана СН4 (тетраэдрическое)
sp 2 – гибридизация: происходит смешение одной S и двух P орбиталей. Образуются три одинаковые гибридные орбитали, они расположены относительно друг друга под углом 120˚, лежат в одной плоскости и стремятся к вершинам треугольника. Образуются 3 ковалентные δ – связи.
Объяснение Характерен для алканов.
Оставшаяся одна негибридизованная орбиталь расположена перпендикулярно плоскости образования δ – связей и участвует в образовании — связи.
рис. Строение молекулы этилена С2Н4 (плоское тригональное)
sp – гибридизация: происходит смешение одной S и одной P орбитали. Образуются две одинаковые гибридные орбитали, они расположены относительно друг друга под углом 180˚, лежат на одной линии. Образуются 2 ковалентные δ – связи.
Объяснение Характерен для алканов.
Оставшиеся две негибридизованные орбитали расположены во взаимно перпендикулярных плоскостях и образуют две — связи.
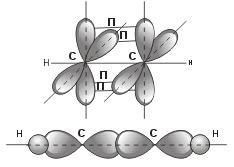
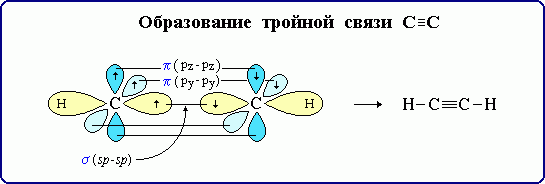
рис. Строение молекулы ацетилена С2Н2 (линейное)
Направленность гибридных орбиталей в пространстве , а следовательно, и геометрическое строение молекул зависят от типа гибридизации. На форму молекулы в пространстве влияет направленность только σ – связей.
5. Упражнение по закреплению и совершенствованию знаний.
1. В предложенных органических соединениях у каждого атома С определите:
б) количество δ (сигма) и (пи) связей.
2. Какие формы в пространстве имеют перечисленные ниже молекулы, какая их геометрия?
6. Контроль знаний, умений, навыков.
— повторить понятия «гомологи», «изомеры».
Источник
FTF 4 semestr / 3
1. Все органические вещества содержат углерод. В молекулах органических веществ углерод переходит в возбуждённое состояние:
2. Органическим соединениям свойственны ковалентные связи. Ковалентная связь в молекулах характеризуется: энергией, длиной, насыщаемостью и пространственной направленностью.
а) Из курса химии 8 класса вы знаете, что ковалентная связь образуется за счёт перекрывания электронных облаков, при этом выделяется энергия, чем больше перекрывание, тем больше выделяется энергии и тем прочнее связь.
Типы перекрываний электронных облаков в порядке возрастания их прочности и энергии выделяемой при образовании:
б) Длина связи определяется расстоянием между центрами ядер связывающихся атомов и измеряется в нанометрах (1 нм = 10 -9 м). С повышением кратности связи (одинарная, двойная, тройная) длина становится меньше, а энергия выше:
в) Под насыщаемостью связи понимают способность образовывать строго определённое количество ковалентных связей.
г) Направленность ковалентной связи определяется взаимным расположением электронных облаков, участвующих в образовании химической связи. Ковалентная связь образуется в направлении максимального перекрывания электронных орбиталей взаимодействующих атомов.
Вы уже знаете, что атом углерода содержит на внешнем уровне четыре валентных электрона:
1 электрон на s – орбитали сферической формы
3 электрона на трёх p – орбиталях, орбитали имеют форму гантели и расположены под углом 90˚.
рис. Атом углерода в возбуждённом состоянии (s 1 px 1 py 1 pz 1 )
Таким образом можно предположить, что в молекуле метана CH4 атом углерода не может образовать 4 одинаковых связи с четырьмя атомами водорода (1 атом водорода имеет 1 электрон на s – орбитали сферической формы). Однако экспериментально доказано, что в молекуле метана все связи С – Н равноценны и направлены к вершинам правильного тетраэдра под углом 109˚28`.
В 1931 г. американский учёный Л. Полинг доказал, что в молекуле метана в момент образования молекулы электронные облака смешиваются и образуют гибридные электронные облака, происходит процесс гибридизации.
Гибридизация – процесс смешения разных, но близких по энергии, орбиталей данного атома, с возникновением того же числа новых гибридных орбиталей, одинаковых по форме и энергии.
В зависимости от числа вступивших в гибридизацию орбиталей атом углерода может находиться в одном их трёх состояний гибридизации: sp 3 , sp 2 , sp.
sp 3 – гибридизация: происходит смешение одной s и трёх p орбиталей. Образуются четыре одинаковые гибридные орбитали, расположенные относительно друг друга под тетраэдрическим углом 109˚28`. Образуются 4 ковалентные σ – связи.
рис. Строение молекулы метана СН4 (тетраэдрическое)
sp 2 – гибридизация: происходит смешение одной s и двух p орбиталей. Образуются три одинаковые гибридные орбитали, они расположены относительно друг друга под углом 120˚, лежат в одной плоскости и стремятся к вершинам треугольника. Образуются 3 ковалентные σ – связи.
Оставшаяся одна негибридизованная орбиталь расположена перпендикулярно плоскости образования σ – связей и участвует в образовании П — связи.
рис. Строение молекулы этилена С2Н4 (плоское тригональное)
sp – гибридизация: происходит смешение одной s и одной p орбитали. Образуются две одинаковые гибридные орбитали, они расположены относительно друг друга под углом 180˚, лежат на одной линии. Образуются 2 ковалентные σ – связи.
Оставшиеся две негибридизованные орбитали расположены во взаимно перпендикулярных плоскостях и образуют две П — связи.
рис. Строение молекулы ацетилена С2Н2 (линейное)
Направленность гибридных орбиталей в пространстве, а следовательно, и геометрическое строение молекул зависят от типа гибридизации. На форму молекулы в пространстве влияет направленность только σ – связей.
СТЕПЕНЬ ОКИСЛЕНИЯ АТОМА УГЛЕРОДА
Для атома углерода в органических соединениях характерны степени окисления от -4 до +4.
Пример №2. Укажите степени окисления всех элементов в CH3CH2OH
Решение. Нахождение степеней окисления в органических соединениях имеет свою специфику. В частности, необходимо отдельно находить степени окисления для каждого атома углерода. Рассуждать можно следующим образом. Рассмотрим, например, атом углерода в составе метильной группы (СН3 –) . Данный атом С соединен с 3 атомами водорода и соседним атомом углерода. По связи С-Н происходит смещение электронной плотности в сторону атома углерода (т. к. электроотрицательность углерода превосходит ЭО водорода). Если бы это смещение было полным, атом углерода приобрел бы заряд -3.
Атом С в составе группы -СН2ОН связан с двумя атомами водорода (смещение электронной плотности в сторону С), одним атомом кислорода (смещение электронной плотности в сторону О) и одним атомом углерода (можно считать, что смещения эл. плотности в этом случае не происходит). Степень окисления углерода равна -2 +1 +0 = -1.
Ответ: С -3 H +1 3C -1 H +1 2O -2 H +1 .
Простая и кратная ковалентные связи
Способность атома углерода иметь разные степени окисления и лёгкость гибридизации позволяет атому углерода образовывать одинарные, и кратные (двойные и тройные связи) не только с другими атомами углерода, но и с атомами других элементов-органогенов:
СН3 – СН3 (1 σ – сигма связь С-С)
CH2=CH2 (1 σ – сигма связь С-С и 1 П – пи связь С-С)
CH ≡ CH (1 σ – сигма связь С-С и 2 П – пи связи С-С)
Источник