Неметаллы — это. Свойства неметаллов
Неметаллы – это элементы, значительно отличающиеся физическими и химическими свойствами от металлов. Подробно объяснить причину их различий смогли только в конце XIX века, после открытия электронного строения атома. В чем же особенность неметаллов? Какие качества характерны дня них? Давайте разберемся.
Неметаллы – это что?
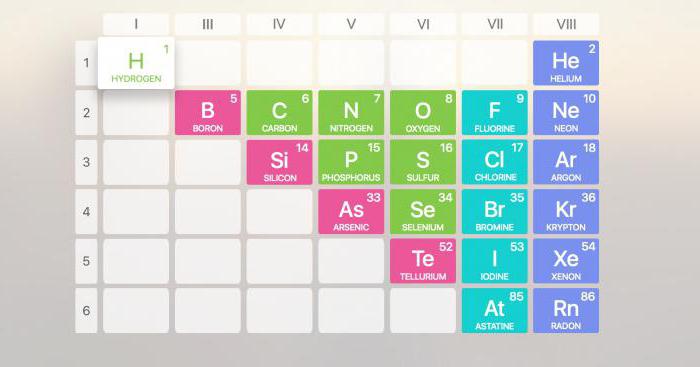
Подход к разделению элементов на металлы и неметаллы давно существует в научной среде. К первым в периодической таблице Менделеева обычно относят 94 элемента. Неметаллы Менделеева включают 22 элемента. В периодической системе они занимают верхний правый угол.
В свободном виде неметаллы – это простые вещества, главной чертой которых является отсутствие характерных металлических свойств. Они могут находиться во всех агрегатных состояниях. Так, йод, фосфор, сера, углерод встречаются в виде твердых веществ. Газообразное состояние характерно для кислорода, азота, фтора и т. д. Жидкостью является только бром.
В природе элементы неметаллы могут существовать как в виде простых веществ, так и в виде соединений. В несвязанном виде встречаются сера, азот, кислород. В соединениях они образуют бораты, фосфаты и т. д. В таком виде они присутствуют в минералах, воде, горных породах.
Отличие от металлов
Неметаллы – это элементы, отличающиеся от металлов внешним видом, строением и химическими свойствами. Они обладают большим числом неспаренных электронов на внешнем уровне, а значит, более активны в окислительных реакциях и легче присоединяют к себе дополнительные электроны.
Характерное различие между элементами наблюдается в строении кристаллической решетки. У металлов она металлическая. У неметаллов она может быть двух видов: атомная и молекулярная. Атомная решетка придает веществам твердость и повышает температуру плавления, она свойственна кремнию, бору, германию. Молекулярной решеткой обладают хлор, сера, кислород. Она придает им летучесть и небольшую твердость.
Внутреннее строение элементов определяет их физические свойства. Металлы имеют характерный блеск, хорошую проводимость тока и тепла. Они твердые, пластичные, поддаются ковке, имеют небольшой цветовой диапазон (черный, оттенки серого, иногда желтоватый цвет).
Неметаллы – это жидкие, газообразные или твердые вещества, не обладающие блеском и ковкостью. Их цвета сильно варьируются и могут быть красными, черными, серыми, желтыми и т. д. Почти все неметаллы плохо проводят ток (кроме углерода) и тепло (кроме черного фосфора и углерода).
Химические свойства неметаллов
В химических реакциях неметаллы могут исполнять роль как окислителей, так и восстановителей. При взаимодействии с металлами они принимают на себя электроны, проявляя таким образом окислительные свойства.
Взаимодействуя с другими неметаллами, они ведут себя по-разному. В таких реакциях менее электроотрицательный элемент проявляет себя как восстановитель, более электроотрицательный выступает окислителем.
С кислородом почти все (кроме фтора) неметаллы проявляют себя восстановителями. При взаимодействии с водородом многие являются окислителями, образуя впоследствии летучие соединения.
Часть элементов неметаллов обладает способностью образовывать несколько простых веществ или модификаций. Это явление называется аллотропией. Например, углерод существует в форме графита, алмаза, карбина и других модификаций. У кислорода их две – озон и собственно кислород. Фосфор бывает красный, черный, белый и металлический.
Неметаллы в природе
В разном количестве неметаллы находятся повсюду. Они входят в состав земной коры, являются частью атмосферы, гидросферы, присутствуют во Вселенной и в живых организмах. В космическом пространстве самыми распространенными являются водород и гелий.
В пределах Земли ситуация совсем иная. Наиболее важные составляющие земной коры – кислород и кремний. Они составляют больше 75 % от её массы. А вот наименьшее количество приходится на йод и бром.
В составе морской воды на кислород приходится 85,80 %, а на водород – 10,67 %. Её состав также включает хлор, серу, бор, бром, углерод, фтор и кремний. В составе атмосферы первенство принадлежит азоту (78 %) и кислороду (21 %).
Неметаллы, такие как углерод, водород, фосфор, сера, кислород и азот, представляют собой важные органические вещества. Они поддерживают жизненную активность всех живых существ на нашей планете, в том числе и людей.
Источник
1. Общая характеристика элементов неметаллов
Из \(118\) известных на данный момент химических элементов \(96\) являются металлическими, и только \(22\) химических элемента относятся к неметаллическим.
Кислород и кремний составляют около \(76\) % (практически три четверти) от массы земной коры (\(O\) — \(49,4\) % , \(Si\) — \(25,8\) % ).
Такие химические элементы, как углерод \(C\), водород \(H\), кислород \(O\), азот \(N\), фосфор \(P\) и сера \(S\), составляют \(98,5\) % от массы растений и \(97,6\) % от массы тела человека.
В состав земной атмосферы входят как простые, так и сложные вещества, образованные элементами-неметаллами.
В объёмных долях на азот N 2 приходится \(78\) % , на кислород O 2 — \(21\) % , а инертные газы составляют \(0,96\) % от объёма воздуха. В состав земной атмосферы также постоянно входит углекислый газ CO 2 , доля которого (по разным оценкам) составляет около \(0,04\) % от состава чистого воздуха.
Следует иметь в виду, что в воздухе постоянно содержится водяной пар H 2 O и другие соединения неметаллов, доля которых не является постоянной.
Главный химический элемент Вселенной — это водород. Из него образованы Солнце и другие звёзды, газовые облака и т. д. И на нашей планете из каждых \(100\) атомов \(17\) — это атомы водорода.
В Периодической системе химических элементов неметаллы занимают правый верхний угол и находятся только в главных (А) группах.
В электронной оболочке атомов неметаллов на внешнем энергетическом уровне, как правило, содержится от \(4\) до \(8\) электронов. Исключение составляют только водород \(H\), у которого в электронной оболочке атома вообще только один электрон, гелий \(He\) с двумя электронами и бор \(B\), у которого на наружном энергетическом уровне имеются три электрона.
Радиусы атомов неметаллов меньше, чем у металлов того же периода, поэтому в силу близости положительно заряженного ядра атома неметаллы хорошо удерживают свои валентные электроны (электроны внешнего энергетического уровня).
Радиусы атомов неметаллов существенно меньше, чем радиусы атомов металлов, находящихся в том же периоде.
Главное отличительное свойство неметаллов — это их высокая электроотрицательность , т. е. способность в химических соединениях притягивать электроны.
Рис. \(6\). Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу)
ОЭО неметаллических химических элементов (выделены красным цветом) превосходит соответствующую величину металлических химических элементов
Атомы неметаллов способны как принимать, так и отдавать электроны, а значит, химические вещества, содержащие такие атомы, в ходе превращений могут выступать как в роли окислителей, так и в роли восстановителей.
Источник
1. Общая характеристика неметаллов
К неметаллам относятся химические элементы, расположенные в правом верхнем углу периодической таблицы. Это \(s\)-элементы (водород и гелий) и часть \(p\)-элементов:
Вспомним строение наружных электронных слоёв атомов неметаллов. Водород и гелий — элементы первого периода. Их электронные формулы: 1 s 1 и 1 s 2 . Электронные формулы внешних слоёв неметаллов \(p\)-семейства приведены в таблице.
- У неметаллов меньшие радиусы атомов по сравнению с металлами.
- Внешний электронный слой атомов неметаллов близок к завершению.
- Неметаллам характерны высокие значения электроотрицательности (\(> 2\) по шкале Полинга).
- Валентные электроны атомов неметаллов сильно связаны с ядром и покидают атом с трудом.
- Атомы неметаллов способны присоединять электроны до заполнения внешнего электронного слоя, но могут также отдавать валентные электроны более электроотрицательным атомам.
В сложных веществах неметаллы могут проявлять положительные и отрицательные степени окисления. Высшая степень окисления, как правило, совпадает с номером группы. Исключения: а) фтор не проявляет положительных степеней окисления; б) максимальная степень окисления кислорода равна \(+2\).
Низшую (минимальную отрицательную) степень окисления для большинства неметаллов можно вычислить, если от номера группы отнять \(8\). Например, степень окисления хлора (элемента седьмой группы) равна \(-1\) (\(7 — 8\)), а селена (элемента шестой группы) равняется \(-2\) (\(6 — 8\)). Исключением является водород, у которого низшая степень окисления равна \(-1\).
У всех неметаллов, кроме фтора, степени окисления переменные. Например, азот образует соединения, в которых он проявляет все степени окисления от минимального значения до максимального: \(-3\), \(-2\), \(-1\), \(0\), \(+1\), \(+2\), \(+3\), \(+4\), \(+5\).
Гелий, неон, аргон не образуют устойчивых соединений, а для ксенона, криптона и радона получены вещества, в которых они положительные: XeF 4 + 4 , RnF 2 + 2 .
Под неметаллическими свойствами обычно понимают способность атомов притягивать электроны. Наиболее ярко выражены неметаллические свойства у фтора; у него самая высокая электроотрицательность.
Если использовать для сравнения периодическую систему, то нужно помнить, что с увеличением порядкового номера неметаллические свойства и электроотрицательность в периодах усиливаются, а в группах — ослабевают.
Атомы неметаллов (кроме инертных газов) в простых веществах соединены ковалентной неполярной связью. В твёрдом состоянии простые вещества-неметаллы образуют два вида кристаллических решёток: молекулярную и атомную. Тип кристаллической решётки определяет физические свойства вещества.
Вещества с молекулярной решёткой летучие, имеют низкие температуры кипения и плавления. При обычных условиях они твёрдые (сера, белый фосфор, йод), жидкие (бром) и газообразны е (водород, кислород, азот, фтор, хлор, инертные газы). Молекулы неметаллов имеют разный состав. Они бывают:
- одноатомные — \(He\), \(Ne\), \(Ar\), \(Kr\), \(Xe\), \(Rn\);
- двухатомные — H 2 , O 2 , N 2 , F 2 , Cl 2 , Br 2 , I 2 ;
- многоатомные — O 3 , P 4 , S 8 .
Вещества с атомной решёткой твёрдые , тугоплавкие, нелетучие и нерастворимые. Такое строение имеют бор, кремний, алмаз, графит, красный фосфор.
Многим неметаллам свойственна аллотропия . Примеры аллотропных модификаций:
- кислород — кислород и озон;
- углерод — алмаз, графит, карбин, фуллерены;
- сера — сера ромбическая, сера моноклинная, сера пластическая;
- фосфор — фосфор белый, фосфор красный, фосфор чёрный.
Один элемент может образовывать вещества с атомной и молекулярной кристаллическими решётками. Так, фосфор белый имеет молекулярное строение, а фосфор красный — атомное; углерод образует вещества с атомной решёткой — алмаз и графит, а также молекулярные фуллерены.
Основу всех живых организмов составляют органогенные неметаллы: углерод, водород, кислород, азот, фосфор, сера.
Три четверти массы земной коры тоже приходится на неметаллы. В неживой природе неметаллы встречаются в виде простых веществ (азот, кислород, бор, углерод, сера) или входят в состав соединений (оксиды, сульфиды, фосфаты, карбонаты, силикаты и т. д.).
Источник