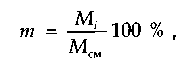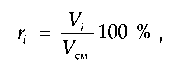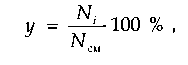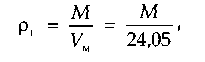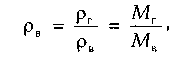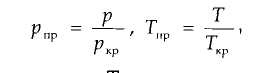Энтальпии 1 м3 газов и воздуха
, ºC
Теоретические объемы сухого воздуха 



Энтальпии 1 м 3 влажного воздуха 



Объемы газов, объемные доли трехатомных газов, концентрация золы



Среднее значение коэффициента α в газоходе
Источник
Энтальпия воздуха и продуктов сгорания котельного топлива. Теплоемкость уходящих дымовых газов.
Энтальпия воздуха и продуктов сгорания 1 кг твердого, жидкого или 1 м 3 газообразного топлива определяется по сумме энтальпий газообразных продуктов сгорания, входящих в состав дымовых газов.
I в ° = α ּV в ° ּСв ּ t в , (1)
где Св — теплоемкость воздуха, м 3 • °С, при его температуре t в , ˚С.
Vв ° — теоретический объем воздуха,
a — коэффициент избытка воздуха ,
Энтальпия газообразных продуктов сгорания, кДж/м 3 (при α = 1),
Iг° = (V R о2 ּ Ссо2 + V N 2 ּ С N 2 + V н2оּСн2о) ּ tг (2)
где Ссо2, СN2 Сн2о — средние объемные теплоемкости двуокиси углерода, азота и водяных паров при постоянном давлении и температуре, кДж/(м 3 ּ°С).
Энтальпия дымовых газов, кДж/м 3 , при α > 1
Теплоемкость газов изменяется в зависимости от их температуры. Средние объемные значения теплоемкости для воздуха, водяного пара и дымовых газов приведены в таблице 14.
Таблица 14. Средняя объемная теплоемкость газов при постоянном давлении и нормальных условиях
Источник
1.4. Состав и свойства природного газа
Природный газ представляет собой смесь предельных углеводородов состава СпН2п+2, в которой содержится метан, этан, пропан, бутан и иногда пары более тяжелых углеводородов. Часто в состав природных газов входят азот N2 (до 40 % по объему), углекислота СО2, сероводород H2S и редкие газы.
В газе газовых и газоконденсатных месторождений обычно преобладает метан; его доля достигает 98,8 %; в нефтяном (попутном) газе доля метана намного меньше, однако увеличивается доля более тяжелых углеводородов — этана, пропана и бутана [5, 7, 13, 41].
Состав газовых смесей выражается в виде массовой, объемной или молярной доли компонентов в процентах. Массовая доля в процентах какого-либо компонента газовой смеси представляет собой отношение массы этого компонента к массе всей смеси:
где Мi — масса i-го компонента; Mсм — масса смеси.
Объемная доля (%) какого-либо компонента в смеси газов равна отношению объема компонента к объему всей смеси:
где Vi — объем /-го компонента в смеси; Vсм — объем всей смеси.
Молярная доля компонента определяется аналогично и может быть представлена в виде
где Ni — число молей г-го компонента в смеси; Ncm — суммарное число молей газа в смеси.
Физические свойства природного газа зависят от его состава, но в целом близки к свойствам метана как основного компонента смеси.
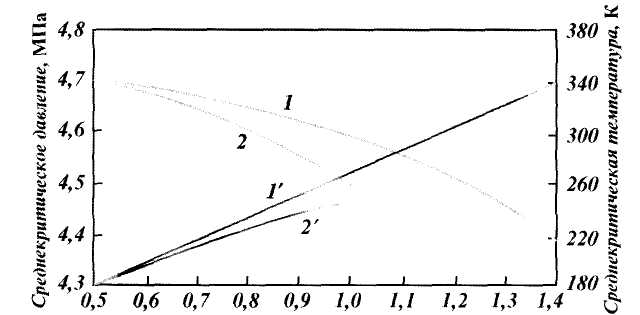
Плотность природного газа можно определить взвешиванием или вычислить, зная молекулярную массу смеси М:
где Vm — объем моля газа при стандартных условиях, м 3 .
Обычно рг находится в пределах 0,73— 1,0 кг/м 3 . В расчетах часто используют более удобную величину — относительную плотность Δ так как значение ее практически не зависит от давления и температуры. За величину сравнения принимают плотность воздуха
где МГ — масса газа; Мв — масса воздуха.
Относительная плотность газа изменяется от 0,50 до 1,0. Плотность индивидуальных компонентов углеводородных газов (и сероводорода), за исключением метана, больше единицы. При всех расчетах, связанных с движением газа, используется вязкость. Аналитические зависимости вязкости смеси от вязкости входящих в смесь компонентов сложны и имеют недостаточную точность. В связи с этим на практике вязкость определяют по экспериментальным графикам, один из которых приведен на рис. 1.2.
Рис. 1.2. Зависимость вязкости природного газа μ (при Δ = 0,6) от температуры
Состояние газа характеризуется давлением р, температурой Т и объемом V. Соотношение между этими параметрами определяется законами идеальных газов (Бойля — Мариотта, Гей-Люссака и др.), которые имеют чрезвычайно большое
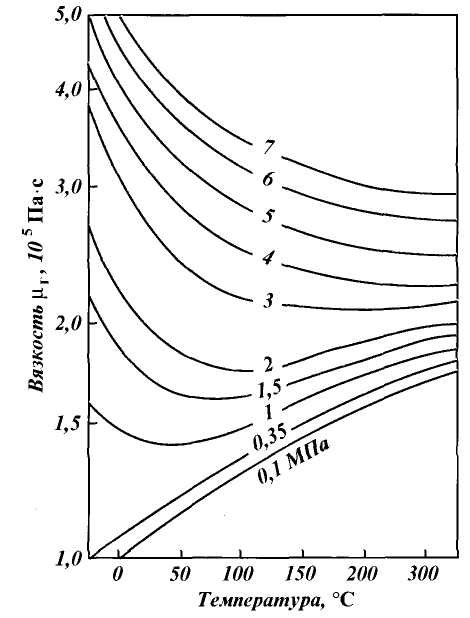
Рис. 1.3. Зависимость коэффициента сжимаемости природного газа от приведенного давления при различных температурах
pV = ZMRT,
где Z — коэффициент сжимаемости; М — масса газа; р — давление; V — объем газа; R — газовая постоянная; Т — абсолютная температура.
Для нефтяных газов значение коэффициента сжимаемости Z можно найти приближенно
Относительная плотность газа
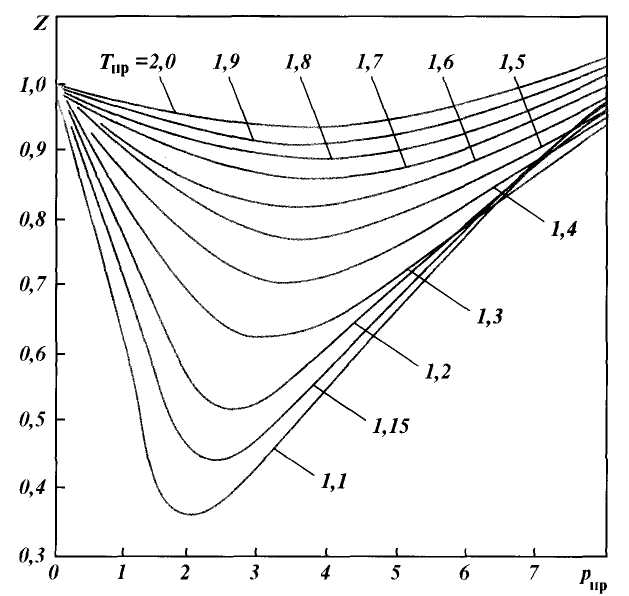
Рис. 1.4. Зависимость среднекритического давления (1, 2) и температуры (1‘ 2′ ) природного газа от относительной плотности:
1, 1‘ — газовое месторождение; 2, 2′ — газоконденсатное месторождение
по графикам Брауна, представленным на рис. 1.3. Коэффициенты сжимаемости Z на этом графике зависят от приведенных давления рпр и температуры Тпр , значения которых можно определить по формулам
где р и Т — соответственно давление и температура газа; ркр и Ткр — критические давления и температура.
Рис. 1.5. Энтальпия природного газа в зависимости от давления и температуры (при относительной плотности газа Δ = 0,6)
газа на конечном участке изменения его давления. Эту величину обычно находят по кривым теплосодержания (рис. 1.5). Зная давление газа и его температуру при одном состоянии, по этим кривым можно найти температуру газа после дросселирования. Для этого от первоначальной точки по линии равного теплосодержания следует переместиться в точку нового значения давления. Температура, соответствующая этой точке, явится искомой величиной. Изменение температуры газа при снижении давления на 0,1 МПа называется коэффициентом Джоуля — Томсона. Эта величина составляет 0,25 — 0,35 °С на 0,1 МПа (1 атм).
Источник
Общие сведения о процессах сжижения газа
В типичной ситуации имеют сырой природный газ высокого давления при температуре окружающей среды. Сжижение газа производится в серии теплообменников (испарителей холодильных машин), которые обеспечивают последовательное охлаждение, полное сжижение и некоторое переохлаждение. Очистка и фракционирование реализуются, как и основная доля охлаждения, под высоким давлением.
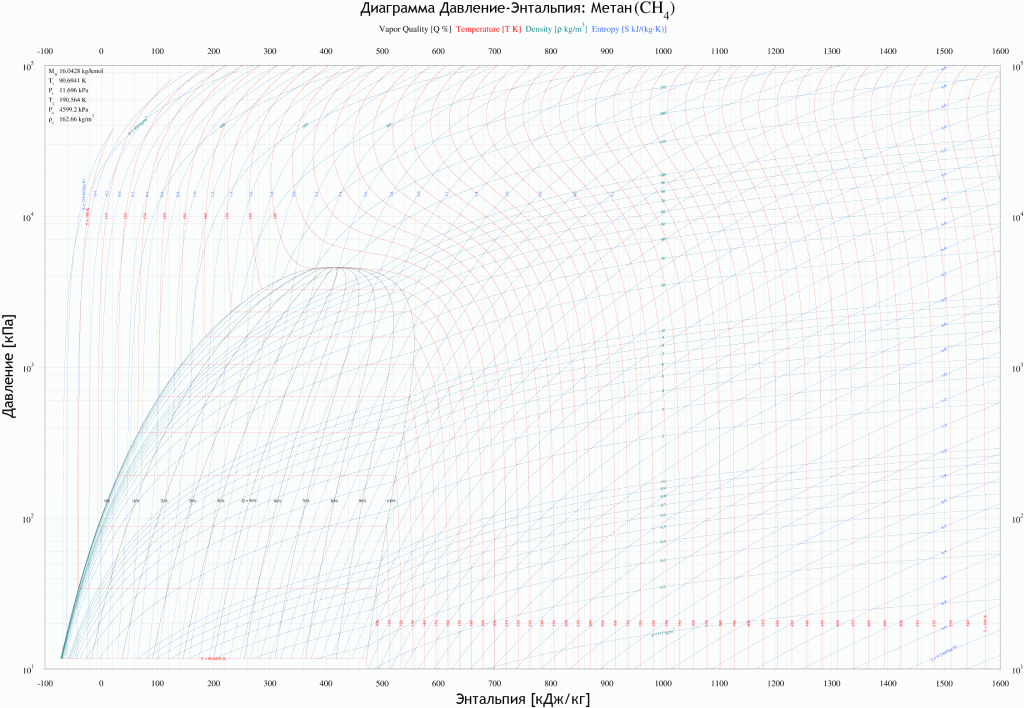
Холод производится одним или несколькими холодильными циклами, позволяющими снизить температуру до –160°С. Количество необходимого холода рассчитывается по энтальпийным диаграммам для природного газа (см. диаграмму «Энтальпия природного газа»).
Энтальпия природного газа (диаграмма давление-энтальпия для метана)
Сжижение завершается однократной сепарацией (изоэнтальпийное расширение после регулируемого штуцера) для снижения давления сжиженного газа до атмосферного.
Выбор холодильных циклов связан с термодинамическими и экономическими соображениями, а также с развитием техники (конструкция и максимальные размеры оборудования, расчет процесса на ЭВМ).
Установки сжижения являются большими потребителями энергии. Эта энергия обычно производится за счет потребления части сжижаемого газа (в тепловом эквиваленте около 12%). На практике в режиме нормальной работы в общем случае используются вместо сырого газа один или несколько производных продуктов, получаемых обязательно при фракционировании (С5+, газ сепарации — СН4 + N2 и т.п.).
Эти производные продукты по количеству и качеству подбираются исходя из состава сырого газа, из выбора коммерциализуемых продуктов фракционирования (т.е. реализуемых на рынке).
Величины температуры и давления, при которых должно происходить фракционирование, важны с точки зрения выбора процесса сжижения.
Источник: «Энциклопедия газовой промышленности» (1994)
Источник