6.2. Химическая природа и структура ферментов
Подобно другим белкам ферменты имеют большую молекулярную массу — от десятков тысяч до нескольких миллионов дальтон и четыре уровня структурной организации: первичный, вторичный, третичный и четвертичный. Большинство ферментов обладают четвертичной структурой.
По своему строению ферменты, как и все белки, делят на простые (ферменты-протеины) и сложные (ферменты-протеиды, или холоферменты). Холоферменты состоят из белковой части — апофермента и небелковой — кофактора. Различают две группы кофакторов: ионы; металлов и коферменты, представляющие собой низкомолекулярные органические вещества. Небелковый компонент — кофактор в сложных ферментах, как правило, составляет незначительную часть от всего фермента. Следует отметить, что апофермент и кофактор порознь мало активны или вообще неактивны, только их комплекс — холофермент проявляет каталитические свойства.
Примерами простых ферментов являются пепсин, трипсин, папаин, уреаза, лизоцим, рибонуклеаза, фосфатаза и другие. Большинство природных ферментов — сложные белки.
В трехмерной структуре и простых, и сложных ферментов с функциональной точки зрения различают ряд участков, среди которых главными являются активный центр и аллостерический (регуляторный) центр.
Активный центр — участок, с которым связывается субстрат (вещество, превращающееся под действием фермента). Обычно активный центр фермента образуют 12-16 остатков аминокислот, в состав активного центра холофермента входит также кофактор. В активном центре различают контактный участок, связывающий субстрат, и каталитический участок, где происходит превращение субстрата после его связывания. Однако это деление условно, так как связывание субстрата в контактном участке влияет на специфичность и скорость превращения его в каталитическом участке. У простых ферментов роль функциональных групп контактного и каталитического центра выполняют только боковые радикалы аминокислот. У сложных ферментов главную роль в этих процессах выполняют кофакторы. Они могут быть или прочно связаны с активным центром фермента, или могут легко отделяться от него при диализе. В первом случае кофакторы часто называют простетической группой, подобно тому, как это принято для небелковой части неферментных белков. Но абсолютной разницы между простетической группой и кофактором нет, так как одни и те же соединения или ионы металлов могут быть и кофактором, и простетической группой в различных ферментах.
Кроме активного центра у ферментов имеется регуляторный, или аллостерический центр, который пространственно разделен с активным центром. Аллостерическим (от греческого alios — иной, чужой) он называется потому, что молекулы, связывающиеся с этим центром, по строению (стерически) не похожи на субстрат, но оказывают влияние на связывание и превращение субстрата в активном центре, изменяя его конфигурацию. Молекула фермента может иметь несколько аллостерических центров.
6.3. Кофакторы ферментов Ионы металлов как кофакторы ферментов
Примерно треть всех известных ферментов является металлозависимыми. Роль металлов в этих ферментах различна. Металлоферменты делятся на следующие группы и подгруппы:
1. Ферменты, где ионы металлов выполняют роль активаторов (эти ферменты катализируют и без металла, но их активность снижается).
2. Ферменты, где ионы металлов выполняют роль кофактора (без ионов металлов эти ферменты неактивны):
2.1) диссоциирующие металлоферменты — (ион металла легко диссоциирует от апофермента);
2.2) недиссоциирующие металлоферменты — металлопротеиды:
В роли кофактора могут выступать ионы различных металлов, чаще всего это ионы Mg 2+ , Мп 2+ ,Zn 2+ , Fe 2+ , Сu 2+ , Са 2+ , Со 2+ , Мо 6+ , K + .
Существует несколько вариантов участия ионов металла в работе фермента. В большинстве случаев ноны металлов вступают в непрочную связь с апоферментом, способствуя формированию каталитически активной третичной и четвертичной структуры апофермента. Стабилизация возможна за счет образования солевых мостиков между ионом металла и карбококсильными группами кислых аминокислот при формировании третичной структуры или между субъединицами при образовании четвертичной структуры. К числу таких ионов относятся Mg 2+ , Мn 2+ , Zn 2+ , Са 2+ и другие. Например, ионы кальция стабилизируют третичную и четвертичнyю структуры α-амилазы, а ионы цинка — алкогольдегидрогеназы; макромолекулы этих ферментов в результате становятся устойчивыми по отношению к пептигидролазам желудочно-кишечного тракта.
В составе металлопротеидов содержатся, как правило, металлы с переменной валентностью (железо, медь, кобальт, молибден). Наиболее многочисленны металлопродеиды класса оксидоредуктаз (катализ реакций окисления — восстановления). Ионы металлов в этих ферментах сами участвуют в транспорте электронов, то есть выполняют функцию каталитического участка. Классическим примером ферментов этого типа служат цитохромы (см. главу 9).
Наконец, многие ионы металлов (Mg 2+ , Мn 2+ , Zn 2+ и другие) активно участвуют в ферментативном катализе, связывая либо субстрат и фермент, либо кофермент с апоферментом. Примером первого случая может служить образование тройного фермент — металл — субстратного комплекса при действии аргиназы, петигидролаз, карбоксилаз и других ферментов. Примером второго рода является присоединение флавинового кофермента к апоферменту с помощью ионов железа, молибдена, меди и цинка.
Источник
1. Химическая природа и строение ферментов
Ферменты – вещества, которые присутствуют в тканях и клетках всех живых организмов и способны во много раз ускорять протекающие в них химические реакции.
Все функциональные проявления живых организмов (дыхание, мышечное сокращение, передача нервного импульса, размножение и т.д.) обеспечиваются действием ферментных систем. История биохимии – это в значительной степени история изучения ферментов. В середине XIX века Луи Пастер уже хорошо понимал, что процессы брожения катализируются ферментами (ферменты – от лат. fermentum брожение, бродильное начало; синоним — энзимы). Но Пастер ошибочно полагал, что ферменты неотделимы от живых клеток. Поэтому важным событием явилось открытие Э. Бухнера, которому в 1897 году удалось показать, что экстрагированные из дрожжевых клеток ферменты способны катализировать спиртовое брожение. Представления о белковой природе ферментов утвердились в 30-х годах ХХ века после того, как Дж. Самнер, Дж. Нортроп и М. Кунитц получили в кристаллическом виде растительную уреазу и ферменты, катализирующие гидролитическое расщепление белков в желудочно-кишечном тракте – пепсин, трипсин, химотрипсин.
Однако, в 80-ых годах Томас Чек и Сидни Альтман обнаружили ферменты – рибонуклеотидной природы – рибозимы, катализирующие один из этапов биосинтеза белка в клетках эукариот – сплайсинг. В 1989 году Чек и Альтман получили Нобелевскую премию по химии за «обнаружение каталитических свойств РНК».
Тем не менее, значительная часть ферментов имеют белковую природу. Ферменты — самый крупный и наиболее высокоспециализированный класс белковых молекул. Они могут быть простыми белками, целиком построенные из полипептидных цепей и распадающиеся при гидролизе только на аминокислоты. Простыми белками являются гидролитические ферменты (например, протеазы, липазы, рибонуклеаза), выполняющие свою функцию в отсутствие кофермента В большинстве случаев ферменты — сложные белки. Сложные белки (холоферменты) содержат наряду с белковой частью (апоферментом) небелковый компонент (кофермент или простетическую группу). Апофермент обеспечивает специфичность действия фермента. Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, FAD, FMN, биотин, липоевая кислота). Во втором случае кофермент взаимодействует с ферментом только на время химической реакции (например, NAD + , NADP + ). Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата. Например, пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования аминокислот.
Более 25% всех ферментов для проявления полной каталитической активности нуждается в ионах металлов. Ионы металла выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента (третичной и четвертичной структур).
Источник
Раздел 4.Ферменты Лекция 5. Строение, механизм действия и классификация ферментов
Ферменты (энзимы) – вещества белковой природы, присутствующие во всех живых клетках и выполняющие роль катализаторов биохимических процессов.
По своему составу ферменты делятся на:
1) простые – состоят только из аминокислот;
2) сложные – состоят из 2-х частей:
— из белковой, которая называется апоферментом и
— небелковой части – кофактора.
Комплекс апофермента и кофактора называется холоферментом.
Ни апофермент, ни кофактор по отдельности не способны катализировать реакцию. Функционально активен только их комплекс.
По своей химической природе кофакторы могут быть представлены как органическими, так и неорганическими соединениями.
Органические кофакторы можно разделить на две группы:
1) простетические группы – кофакторы, которые прочно соединены с апоферментом и при выделении из организма не отсоединяются от белковой части.
Например, ФАД в составе фермента сукцинатдегидрогеназы из цикла Кребса.
2) коферменты – кофакторы, которые соединены с апоферментами слабыми связями и легко от него отщепляются: например, НАД, НАДФ, а иногда и ФАД.
Неорганические кофакторы представлены ионами металлов (чаще всего ионами железа, меди, марганца, цинка и т.д.). Ионы металлов как кофакторы либо непосредственно участвуют в акте катализа, либо образуют мостики, связывающие фермент с субстратом.
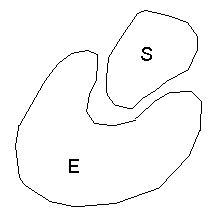
Субстрат (S) – вещество, химические превращения которого катализирует фермент.
Строение фермента, или энзима (Е):
Поскольку молекулы субстрата обычно мельче молекул ферментов, то в непосредственный контакт с субстратом вступает только часть молекулы фермента – активный центр. Причем, геометрическая форма поверхности участка молекулы субстрата является комплементарной поверхности активного центра.
Активный центр фермента – уникальная комбинация аминокислотных остатков, обеспечивающая взаимодействие с молекулой субстрата и участвующая в акте катализа. У сложных ферментов в состав активного центра обязательно входит кофактор.
Активный центр может иметь 2 участка:
- якорный (субстратный);
- каталитический.
- Катализ осуществляется в очень мягких условиях (Т, рН)
- Высокая эффективность: ферменты увеличивают скорость реакции
- Специфичность действия. Каждый фермент ускоряет только 1 реакцию. Виды специфичности:
- Возможность тонкой и точной регуляции скорости реакции изменением условий среды (связано с белковой природой фермента)
- Возможность насыщения фермента субстратом (особенности кинетики).
- Ферментативный катализ – это строго запрограммированный процесс (1 реакция; 1 субстрат; 1 фермент) – серия элементарных превращений вещества, строго организованных в пространстве и времени.
Источник