Спр. материал / ГОРМОНЫ2 / ТКАНЕВЫЕ ГОРМОНЫ
Тканевые гормоны синтезируются специализированными клетками различных тканей. Они обладают аутокринным и паракринным действием, т. е. дистантность действия у тканевых гормонов небольшая. По химической природе тканевые гормоны можно разделить на три группы:
1) эйкозаноиды (производные арахидоновой кислоты);
2) тканевые гормоны пептидной природы;
3) биогенные амины (производные аминокислот).
• Эйкозаноиды — это вещества, которые синтезируются почти всеми типами клеток из арахидоновой кислоты и как гормоны местного действия вызывают эффект по паракринному или аутокринному механизму через специфические рецепторы. Эйкозаноиды — физиологически и фармакологически активные вещества. К ним относятся: 1) простагландины; 2) простациклины и тромбоксаны; 3) лейкотрие-ны. Предшественником их является арахидоновая кислота, которая образуется при действии фермента фосфолипазы А2 на фосфолипиды мембран клеток
В некоторых случаях действие эйкозаноидов опосредовано путем регуляции синтеза цАМФ или цГМФ. Также они могут сами служить вторичными мессенджерами действия гидрофильных гормонов. Эйкозаноиды принимают участие в высвобождении продуктов внутриклеточного синтеза (гормонов, НС1, мукоидов), оказывают влияние на метаболизм костной ткани, иммунную систему, участвуют в воспалительных и аллергических реакциях.
Противовоспалительное действие некоторых лекарственных препаратов можно объяснить тем, что они ингибируют синтез проста-гландинов, которые активно образуются в очаге воспаления и являются эффективными лигандами болевых рецепторов. Так, кортико-стероиды ингибируют фермент фосфолипазу А2 и поэтому являются более эффективными противовоспалительными средствами, чем ацетилсалициловая кислота или индометацин — ингибиторы циклоокси-геназы, катализирующей синтез простагландипов из арахидоиовой кислоты (см. рис. 4.10).
1. Простагландины при введении в организм вызывают сокращение матки, регулируют приток крови к определенному органу, оказывают влияние на кровяное давление, контролируют транспорт ионов через мембраны. Характер их воздействия зависит от типа клетки, в которой они синтезируются. Простагландины используются в медицине как лекарственные средства для стимулирования нормальных родов, прерывания беременности, предупреждения развития или обезболивания язвы желудка, лечения воспалительных процессов, регуляции кровяного давления, снятия приступов астмы.
2. Простациклины образуются в клетках кровеносных сосудов и являются сильными ингибиторами агрегации тромбоцитов. Соотношение тромбоксанов и простациклинов определяет условия тромбо-образования на поверхности эндотелия сосудов.
3. Лейкотриены образуются в лейкоцитах, в клетках мастоцитомы, тромбоцитах и макрофагах по липоксигеназному пути в ответ на иммунологические и неиммунологические реакции. Лейкотриены — медиаторы воспаления, вызывающие сокращение мышечной ткани бронхов в концентрациях в 100 — 1 000 раз меньше, чем гистамин; способствуют сокращению коронарных сосудов.
• К тканевым гормонам пептидной природы относятся гормоны желудочно-кишечного тракта (табл. 4.3).
Из тканей ЖКТ выделено более 12 пептидов, обладающих специфическим действием. Большинство этих пептидов существует во множественных формах.
Среди пептидов ЖКТ можно выделить такие, которые соответствуют классическому определению «гормон». К ним относятся гаст-рин, секретин, желудочно-ингибиторный полипептид, холецистокинин, панкреатический полипептид, энтероглюкагон. Другие обладают только паракринным эффектом или действуют как локальные нейромеди-аторы или нейромодуляторы. Они имеют в плазме крови очень корот-
кий полупериод жизни и не играют в ней физиологической роли. К таковым относятся вазоактивный интестинальныи пептид, соматоста-тин, вещество Р, энкефалины, бомбезин, нейротензин.
Ангиотензин II является гормоном и нейромедиатором; оказывает различное действие на органы и ткани (табл. 4.4).
Механизм действия гормонов ЖКТ — мембранный. Вторичными посредниками передачи сигнала являются ионы Са2+ (для ХЦК, гаст-рина, бомбезина, вещества Р) или цАМФ (для секретина, ВИП).
Другими представителями тканевых гормонов пептидной природы являются ангиотензин II, эритропоэтин, кинины.
Ангиотензин II имеет два предшественника. Белок-ангиотензино-ген вырабатывается в печени и транспортируется в крови с фракцией а2-глобулинов. При снижении артериального давления в почках в юкстагломерулярных клетках вырабатывается протеолитический фермент ренин, отщепляющий в крови от ангиотензиногена с N-конца декапептид — ангиотензин I. Далее ангиотензин I под действием фермента карбоксидипептидилпептидазы (ангиотензин-конвертиру-ющий фермент), локализованного в мембране клеток кровеносных сосудов (особенно в легких), превращается в ангиотензин II (октапеп-тид).
Эритропоэтин — гликопротеин, который образуется в почках и печени. Этот гормон контролирует дифференцировку стволовых клеток костного мозга, способствует образованию эритроцитов и синтезу гемоглобина. Секреция эритропоэтина снижается в результате понижения парциального давления кислорода (различные типы гипоксии). Нарушение функции почек ведет к снижению секреции эритропоэтина и развитию анемии.
Также биологически активными веществами пептидной природы являются кинины — каллидин, брадикинин. Белки-предшественники кининов образуются в печени. В тканях и плазме крови происходит образование фермента калликреина, превращающего кининоген в ки-нин. Под действием тканевого калликреина синтезируется каллидин. Последний в плазме крови под влиянием плазматического калликреина превращается в брадикинин. Биологическая активность брадики-нина и каллидина проявляется в очаге воспаления. Кинины расширяют сосуды, повышают проницаемость капилляров, являются медиато- • рами боли.
• Биогенные амины — гормоны, образующиеся при декарбокси-лировании некоторых аминокислот:
Декарбоксилазы аминокислот содержат в качестве кофермента пиридоксальфосфат. Одним из хорошо изученных ферментов является декарбоксилаза ароматических аминокислот, которая содержится в ЦНС, надпочечниках и играет важную роль в регуляции содержания биогенных аминов. Биогенные амины оказывают сильное фармакологическое действие на многие физиологические функции организма.
Накопление биогенных аминов может вызвать существенные нарушения функций организма. Однако в организме имеются специальные механизмы их обезвреживания, которые сводятся к окислительному дезаминированию этих аминов с образованием соответствующих альдегидов и выделением аммиака:
Ферменты, катализирующие эти реакции, называются моноамин-оксидазами (МАО) (в случае моноаминов) и диаминоксидазами (ДАО) (в случае диаминов). Моноаминоксидаза — это ФАД-содер-жащий фермент, регулирующий скорость биосинтеза и распада биогенных аминов. Ферментативный процесс протекает в две стадии:
Некоторые ингибиторы МАО (депреиил, ниаламид, пиразидол) используются при лечении болезни Паркинсона, шизофрении, депрессивных состояний и др.
Гистамин относится к наиболее изученным биогенным аминам. На основании функциональных и морфологических различий депо гистамина в организме разделяют на два типа: депо неспецифических тучных клеток и специфические тканевые депо. Гистамин, секрети-руемый тучными клетками, участвует во многих неспецифических реакциях организма (воспалении, иммунных реакциях и др.). Специфические депо связаны с самой функцией тканей, где гистамин играет роль медиатора. В желудочно-кишечном тракте (слизистая оболочка желудка и 12-перстной кишки), где синтезируется большая часть всего гистамина организма, примерно 80 % его локализовано в специфических клеточных депо и только 20 % — в тучных клетках обычного типа. К специфическим тканевым депо относят также клетки, содержащие гистамин в поджелудочной железе и нервной системе. Гемато-энцефалический барьер почти непроницаем для гистамина, поэтому содержащийся в тканях мозга гистамин является результатом эндогенного синтеза в клетках мозга.
Источник
Пептидные гормоны
К пептидным гормонам относятся окситоцин, вазопрессин, гастрин, глюкагон, инсулин и другие.
Окситоцин — 9-членный пептид, продуцируемый задней долей гипофиза.Окситоцин уже через 20—ЗО с после внутривенного введения в количестве всего лишь 1 мкг стимулирует выделение молока молочными железами. Кроме того, по мере приближения родов усиливается чувствительность к окситоцину мышц матки, сокращающихся под его воздействием. Поэтому данный гормон способствует нормальному протеканию родов, причем именно это вещество позволяет роженице не связывать болевые ощущения при родах с новорожденным, позволяет забыть боль при родах. Этот гормон можно назвать гормоном заботы и любви. Он влияет на психо-эмоциональное состояние женщин. Сразу после родов он вырабатывается в большом количестве для формирования нежного и заботливого отношения в системе ребенок-мать.
Вазопрессин по структуре и функциональной активности сходен с окситоцином. Однако его действие направлено в основном на регуляцию водного обмена, он повышает кровяное давление. В дикой природе у тех животных, которые вырабатывают много окситоцина и вазопрессина, например, у лебедей и мышей-полевок образуются устойчивые пары.
Гастрин — I7-членный пептид, выделяемый слизистой желудка. Он стимулирует секрецию желудочного сока.
Инсулин — белок, вырабатываемый в клетках поджелудочной железы, он регулирует углеводный обмен, способствуя проникновению глюкозы в клетку, снижает активность ферментов, расщепляющих гликоген в печени. Кроме инсулина поджелудочная железа вырабатывает еще два гормона – глюкагон (антагонист инсулина) и липокаин (регулятор обмена липидов).
Механизм действия пептидных гормонов.
Пептидные гормоны не проникают внутрь клеток – мишеней, они взаимодействуют с белковыми рецепторами, расположенными на наружней стороне поверхности плазматической мембраны. Подавляющее большинство гормонов пептидной природы действуют по так называемому аденилатциклазному механизму: комплекс белка-гормона с рецептором активирует фермент аденилатциклазу, ускоряющую образование циклического АМФ (Рис.14). Ц-АМФ обладает способностью активировать особые ферменты — протеинкиназы, которые катализируют реакции фосфорилирования различных белков с участием АТФ. При этом в состав белковых молекул включаются остатки фосфорной кислоты. Главным результатом этого процесса фосфорилирования является изменение активности фосфорилированного белка. В различных типах клеток фосфорилированию в результате активации аденилат-циклазной системы подвергаются белки с разной функциональной активностью. Например, это могут быть ферменты, ядерные белки, мембранные белки. В результате реакции фосфорилирования белки могут становятся функционально активными или неактивными. Такие процессы будут приводить к изменениям скорости биохимических процессов в клетке-мишени.
Гормоны – производные аминокислот (прочие гормоны)
К группе прочих гормонов относятся адреналин и норадреналин, вырабатываемые мозговым слоем надпочечников; гормоны щитовидной железы – тироксин и трийодтиронин.
Адреналин и норадреналин являются производными протеиногенной аминокислоты тирозина
Эти гормоны вызывают повышение кровяного давления (кроме сосудов мозга и легких), усиливают сердечную деятельность, сокращение гладкой мускулатуры, активирует гликогенфосфорилазу, липазу, способствуют расслаблению мышц бронхов и кишечника. Эти гормоны действуют по аденилатциклазному механизму.
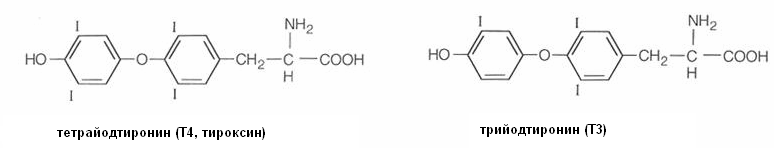
Тироксин (тетрайодтиронин) и трийодтиронин также являются производными тирозина (Рис.32), они влияют на активность многих ферментов, локализованных в митохондриях, регулируют процессы биологического окисления в организме, обмен жиров и воды, влияют на развитие организма в целом. Щитовидная железа – основное депо йода в организме. У китов в этой железе содержание йода достигает 1 г/кг. При гиперфункции щитовидной железы усиливаются окислительные процессы, нарушается сердечная и психическая деятельность, наблюдается общее истощение организма, пучеглазие (базедова болезнь).
Рис.32. Строение гормонов щитовидной железы
Источник