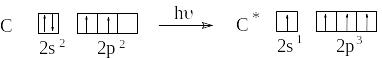- Теория химического строения А.М. Бутлерова
- Электронные теории химической связи
- Основные принципы квантовой органической химии
- 1. Атом, изотоп, химический элемент, вещество ( простое, сложное, реальное, раствор, смесь).
- 2. Способы выражения состава раствора. Концентрация (молярная, моляльная, массовая доли).
Теория химического строения А.М. Бутлерова
В 1861 году А.М. Бутлеровым была предложена теория химического строения органических соединений, которая состоит из следующих основных положений.
- В молекулах веществ существует строгая последовательность химического связывания атомов, которая называется химическим строением.
- Химические свойства вещества определяются природой элементарных составных частей, их количеством и химическим строением.
- Если у веществ с одинаковым составом и молекулярной массой различное строение, то возникает явление изомерии.
- Так как в конкретных реакциях изменяются только некоторые части молекулы, то исследование строения продукта помогает определить строение исходной молекулы.
- Химическая природа (реакционная способность) отдельных атомов в молекуле меняется в зависимости от окружения, т.е. от того, с какими атомами других элементов они соединены.
Теория Бутлерова дает принципиальную возможность познания геометрии молекулы (микроскопических свойств) через познание химических свойств (макроскопических свойств). Основные положения теории строение сохраняют свое значение до сих пор.
Электронные теории химической связи
Г.Льюисом и В.Косселем (1916 г.) была предложена электронная теория химической связи. Согласно этой теории ковалентная связь образуется за счет пары электронов, общей для двух связываемых атомов. Частица устойчива, если валентная оболочка элементов первого периода (Н) содержит два (правило дублета), а элементов второго периода (C, N, O, F) — восемь электронов (правило октета).
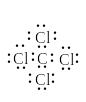
Электронное строение органических соединений изображают с помощью электронных формул Льюиса. В них с помощью точек указывают положение всех валентных электронов: электронов химических связей и неподеленных пар электронов. При этом считают, что неподеленные пары электронов составляют часть внешней оболочки только одного атома, а электроны, участвующие в образовании ковалентной связи, являются ч астью внешней оболочки обоих атомов. Например, в приведенной ниже формуле Льюиса для тетрахлорметана все атомы имеют октет электронов.
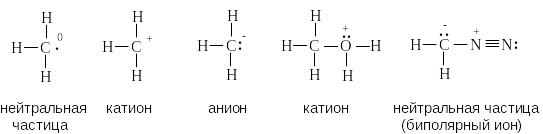
Для каждого атома в структуре Льюиса определяют формальный заряд. При этом полагают, что атому принадлежат все неподеленные электроны и половина электронов ковалентных связей. Избыток электронов, принадлежащих атому в молекуле по сравнению со свободным атомом, обусловливает отрицательный заряд, а недостаток — положительный заряд. Сумма формальных зарядов всех атомов дает заряд частицы в целом.
Основные принципы квантовой органической химии
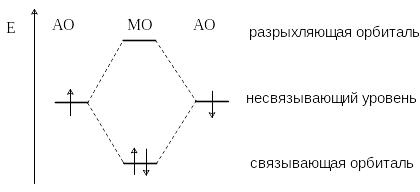
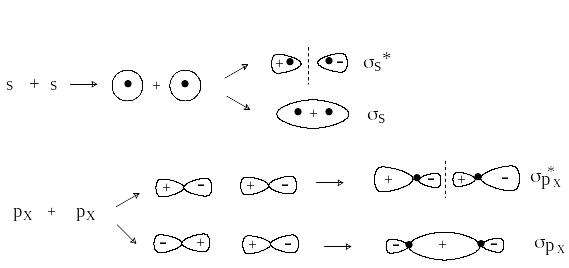
С овременные теории ковалентной связи основаны на представлениях квантовой механики. Согласно принципам квантовой механики состояние электрона в атоме определяется волновой функцией, которую называют атомной орбиталью. Образование химической связи между атомами рассматривается как результат взаимодействия двух орбиталей, на каждой из которых находится по одному электрону. При этом происходит образование молекулярных орбиталей (МО). Из двух атомных орбиталей образуются две молекулярные орбитали, одна из которых (связывающая) имеет более низкую энергию, а другая (разрыхляющая) – более высокую энергию, чем исходные АО.
Электроны связи занимают более низкую по энергии связывающую орбиталь, таким образом, взаимодействие орбиталей приводит к выигрышу в энергии.
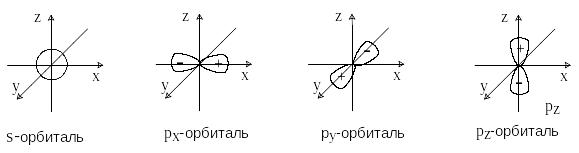
В зависимости от типа комбинирующихся атомных орбиталей образуются разные типы МО. Определяющую роль в этом играют симметрия и узловые свойства орбиталей. Атомные s-орбитали имеют симметрию шара и не имеют узловых поверхностей, проходящих через центр атома. Атомные p-орбитали имеют цилиндрическую симметрию и три состояния px, py и pz. Каждая p-орбиталь имеет узловую плоскость, проходящую через центр атома и перпендикулярную соответственно оси x, y или z.
Узловая поверхность – это место, где вероятность нахождения электрона равна нулю, а волновая функция меняет знак. Чем больше узлов, тем выше энергия орбитали. Таким образом, p-орбиталь состоит из двух частей, в которых знаки волновых функций противоположны.
П ри комбинировании по оси х двух s-орбиталей, s-орбитали и px-орбитали или двух px-орбиталей образуются -МО: связывающие () и разрыхляющие ( * ).
-МО имеют цилиндрическую симметрию. Разрыхляющие * -МО имеет узловую плоскость, проходящую между ядрами.
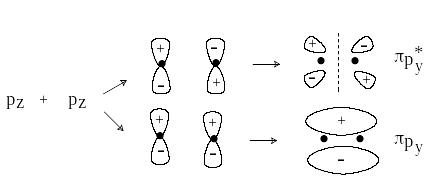
П ри комбинировании вдоль оси х двух ру или двух рz-орбиталей образуются МО -типа.
Связывающая -МО имеет узловую плоскость, проходящую через линию, соединяющую ядра атомов. Разрыхляющая * -МО имеет, кроме того, узловую плоскость, проходящую между ядрами.
При рассмотрении электронного строения многоатомных молекул необходимо использовать такой набор орбиталей, при котором достигается их максимальное перекрывание. В связи с этим водится понятие гибридизации орбиталей. Атом углерода в возбужденном состоянии содержит четыре неспаренных электрона на внешнем энергетическом уровне и способен образовать четыре ковалентных связи.
В образовании связей участвуют гибридные орбитали.
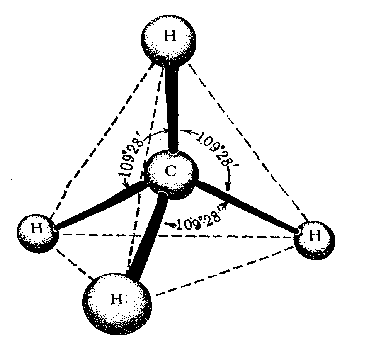
Первое валентное состояние – sp 3 -гибридизация. В результате гибридизации с участием одной s и трех p орбиталей атома углерода образуются четыре эквивалентные sp 3 -гибридные орбитали, направленные к вершинам тетраэдра под углами 109,5 о :
В состоянии sp 3 -гибридизации атом углерода образует четыре -связи с четырьмя заместителями и имеет тетраэдричекую конфигурацию с валентными углами, равными или близкими 109,5 о :
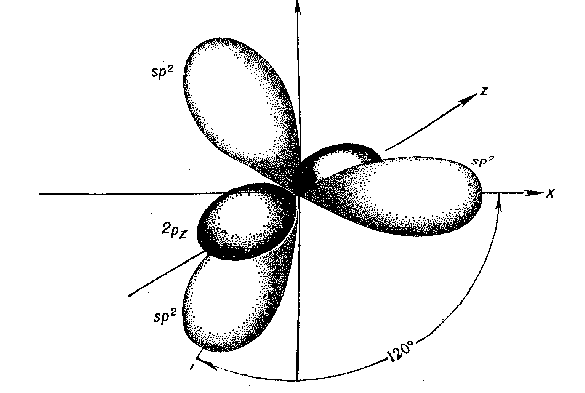
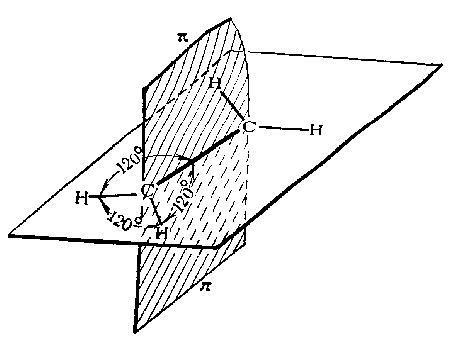
Второе валентное состояние – sp 2 -гибридизация. В результате гибридизации с участием одной s- и двух p-орбиталей атома углерода образуются три эквивалентные sp 2 -гибридные орбитали, лежащие в одной плоскости под углами 120 о , а не участвующая в гибридизации p-орбиталь расположена перпендикулярно плоскости гибридных орбиталей.
В состоянии sp 2 -гибридизации атом углерода образует три -связи за счет гибридных орбиталей и одну -связь за счет не участвующей в гибридизации p-орбитали и имеет три заместителя:
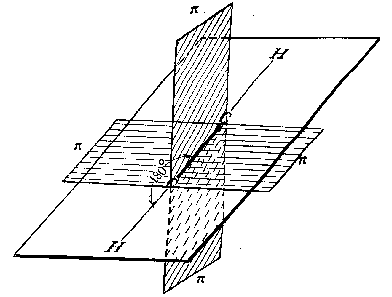
Третье валентное состояние углерода – sp-гибридизация. В результате гибридизации с участием одной s- и одной p–орбитали образуются две эквивалентные sp-гибридные орбитали, лежащие под углом 180 0 , а не участвующие в гибридизации p-орбитали расположены перпендикулярно плоскости гибридных орбиталей и друг другу. В состоянии sp-гибридизации атом углерода образует две -связи за счет гибридных орбиталей и две -связи за счет не участвующих в гибридизации p-орбиталей и имеет два заместителя:
Таблица 3.1. Зависимость структуры соединений от типа гибридизации углерода.
Геометрия и валентный угол
Источник
1. Атом, изотоп, химический элемент, вещество ( простое, сложное, реальное, раствор, смесь).
Химия — наука о веществах и их превращениях в данных, конкретных химических системах.
Химическая система – совокупность микро и макро количеств веществ, способных под воздействием различных внешних факторов (условий) к превращениям с образованием новых химических соединений.
Атом — (от греч. atomos — неделимый), наименьшая частица хим. элемента,(определяющая) носитель его св-в. Электро нейтральная (устойчивая)система, состоящая из положительно заряженного ядра, окруженного облаком отрицательно заряженных электронов.
Хим. элементы — совокупность атомов с определенным (одинаковым)зарядом ядра Z, т.е. одинаковым порядковым номером в периодической системе. Обозначение: 6 12 С, где С – символ; 12 – массовое число = сумме р + и n 0 ; 6 – порядковый номер, заряд ядра, число р + , число е — .
Изотопы— атомы одного химического элемента с одинаковым зарядом ядра, но с разным массовым числом из-за разного количества нейтронов в ядре.пример: 

Молекула – наименьшая частица химического вещества, определяющая его свойства, способная к самостоятельному существованию как единая динамическая система двух и более ядер и электронов.
Вещество – особый вид материи, обладающий массой покоя и состоящий из элементарных частиц (е, р, n).
Любое вещество состоит из структурных единиц – атомов, молекул, ионов, мицелл, комплексов.
Простые вещества – молекулы состоят из атомов одного и того же хим эл-та. Пр: S, Fe, O3, С, N2.
Сложные вещества – молекулы состоят из атомов разных химических элементов
Реальное вещество — вещ-во со всякими примесями.
Ионы – структурные ед реального в-ва (одно или много атомные), несущие в себе электрический заряд. Катионы H + , Анионы Cl —
Растворы — гомогенные системы, состоящие из 2х или более компонентов.
Смесь— НЕЧТО состоящее из молекул разных веществ.
— Продукт смешения, механического соединения каких-либо веществ, характеризующаяся содержанием примесей выше определенного предела. Пр: горючая смесь, гелиево-кислородная смесь
2. Способы выражения состава раствора. Концентрация (молярная, моляльная, массовая доли).
Растворы бывают: газовые (газовые смеси), жидкие и твердые. Относит. содержание компонента в растворе характеризуется его концентрацией.
По числу компонентов: Бинарные (2 компонента) и многокомпонентные. Растворитель — тот, что в избытке.
По агрегатному состоянию: Жидкие (водные и неводные) Твёрдые (растворы внедрения и замерзания) Газообразные (равновесные смеси газов в любых соотношениях)
По концентрации: Разбавленные (С 0,01) Концентрированные (С = 1 моль/л) Насыщенные (С > 1?)
По природе растворённого вещества: Электролиты (сильные ( = 1) и слабые ( < 30%)), = распавшихся / растворённых. Неэлектролиты.
По реальности: Идеальные (нет взаимодействия между AX–S, S–S, AX–AX). AX — растворённое. Реальные.
Условие образования идеального раствора: Hид = 0, S > 0, V = 0.
Концентрация — отношение числа частиц компонента системы (смеси, р-ра, сплава), его кол-ва (молярная К.) или массы (массовая К.) / к объему системы. Единицы измерения — соотв. м -3 , моль/м 3 или кг/м 3 .
Молярная доля [%]: количество компонента в растворе / к общему количеству компонентов.
Молярная концентрация [моль/л]: (молярность) показывает число молей растворенного вещества, содержащегося в 1 литре раствора: М = v(Х) / V, где М — молярная концентрация растворенного вещества X, моль/л; v(Х) — количество растворенного вещества X, моль; V — объем раствора, л.
Моляльная доля растворенного вещества (Моляльность) [моль/кг] — безразмерная величина, равная отношению количества растворенного вещества к общему количеству веществ в растворе:
где N(Х) — мольная доля растворенного вещества X; v(Х) — количество растворенного вещества X, моль;
v(S) — количество вещества растворителя S, моль.
Массовая доля[%] — это отношение массы растворенного вещества к общей массе раствора. Для бинарного раствора ω(x) = m(x) / (m(x) + m(s)) = m(x) / m, где ω(х) — массовая доля растворенного вещества Х, m(x) — масса растворенного вещества Х, г; m(s) — масса растворителя S, г; m = m(x) + m(s) — масса раствора, г.
(Массовая доля: масса компонента / к массе раствора (сколько граммов на 100 г раствора).)
Источник