Индикаторы применение индикаторов природные индикаторы
Природные индикаторы
Автор работы награжден дипломом победителя II степени
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке «Файлы работы» в формате PDF
Каждый человек, который любит пить чай с лимоном, не раз замечал, что напиток при добавлении лимона становится светлее. При добавления уксуса в борщ суп становится ярко-красным, а при добавлении соды в тесто моего любимого торта «Черный принц» оно меняет окрас с буро-красного цвета в темно-зеленый. Почему же так происходит? Что заставляет цвета так быстро меняться?
Спросив об этом учителя химии, я узнала, что для этого есть несколько причин. Во-первых, есть различные растения, соки которых изначально имеют яркую окраску, а во-вторых на изменение окраски влияет условие, в котором оказались эти соки. Это условие называется среда раствора. Она бывает щелочной, нейтральной и кислой.
Растворы всех кислот и щелочей бесцветны, большинство из них не пахнут. Как же тогда можно определить, что в одном сосуде находится кислота, а в другом – щёлочь? Тогда на помощь приходят индикаторы. В переводе с лытыни indicator – указатель. Они буквально указывают нам, где среди растворов кислая, щелочная или нейтральная среда.
Промышленность выпускает десятки разнообразных индикаторов. А как же быть в том случае, если дома у вас нет химических индикаторов, а необходимо определить реакцию среды продуктов питания или средств бытовой химии? Можно ли приготовить индикатор без использования химических реактивов? Какие растения могут использоваться в качестве индикаторов? Можно ли приготовить растворы растительных индикаторов самостоятельно? Пригодны ли самодельные индикаторы для использования при проведении экспериментов? Все эти вопросы и побудили меня к изучению темы «Индикаторы».
Мы поставили перед собой цель: рассмотреть возможность использования в качестве индикаторов растительное сырье.
В ходе работы нам пришлось решить следующие задачи:
познакомиться с имеющимися в химической лаборатории школы индикаторами, их действием на кислотную, щелочную и нейтральную среду;
выяснить, сок (отвар, настой) каких растений пригоден для определения среды растворов;
приготовить индикатор из доступного сырья и изучить его действие в различных средах;
разработать шкалу индикации различных сред на основе самодельного индикатора;
проверить его действие в бытовых условиях.
Объектом исследованиястали листья и цветы следующих растений: краснокочанная капуста, красная роза, каркадэ (Суданская роза), черная смородина, черноплодная рябина, Ирезине (приложение 1, рис.1-6).
ОСНОВНАЯ ЧАСТЬ
Историческая справка
Впервые вещества, меняющие свой цвет в зависимости от среды, обнаружил в XVII веке английский химик и физик Роберт Бойль. Он провел тысячи опытов [1]. Вот один из них.
В лаборатории горели свечи, в ретортах что-то кипело, когда некстати зашел садовник. Он принес корзину с фиалками. Бойль очень любил цветы, но предстояло начать опыт. Он взял несколько цветков, понюхал и положил их на стол. Опыт начался, открыли колбу, из нее повалил едкий пар. Когда же опыт кончился, Бойль случайно взглянул на цветы, они дымились. Чтобы спасти цветы, он опустил их в стакан с водой. И – что за чудеса — фиалки, их темно-фиолетовые лепестки, стали красными. Случайный опыт? Случайная находка? Роберт Бойль не был бы настоящим ученым, если бы прошел мимо такого случая. Ученый велел готовить помощнику растворы, которые потом переливали в стаканы и в каждый опустили по цветку. В некоторых стаканах цветы немедленно начали краснеть. Наконец, ученый понял, что цвет фиалок зависит от того, какие вещества содержатся в растворе. Затем Бойль заинтересовался, что покажут не фиалки, а другие растения.
Он приготовил для своих опытов водный настой лакмусового лишайника. Склянка, в которой он хранил настой, понадобилась для соляной кислоты. Вылив настой, Бойль наполнил склянку кислотой и с удивлением обнаружил, что кислота покраснела. Заинтересовавшись этим, Бойль на пробу добавил несколько капель настоя лакмуса к водному раствору гидроксида натрия и обнаружил, что в щелочной среде лакмус синеет.
Эксперименты следовали один за другим, проверялись васильки и другие растения, но всё же лучшие результаты дали опыты с лакмусовым лишайником. Так, в 1663 году, был открыт первый индикатор для обнаружения кислот и оснований, названный по имени лишайника лакмусом.
В 1667 году Роберт Бойль предложил пропитывать фильтровальную бумагу отваром тропического лишайника – лакмуса, а также отварами фиалок и васильков. Высушенные и нарезанные «хитрые» бумажки Роберт Бойль назвал индикаторами, что в переводе с латинского означает «указатель», так как они указывают на среду раствора.
Лакмус стал самым древним кислотно-основным индикатором. Надо сказать, что само красящее вещество лакмус был известен ещё в Древнем Египте и Древнем Риме. Его добывали из некоторых видов лишайников, произраставших на скалах Шотландии, и использовали в качестве фиолетовой краски, но со временем, рецепт его приготовления был утерян.
Что такое кислотность раствора?
Характер среды (кислая, щелочная, нейтральная) зависит от количества (концентрации) ионов водорода Н + , поэтому часто характеризуется как кислотность, так как водород неотъемлемая часть любой кислоты. Всем известна формула воды – Н2О. Но, оказывается, ее можно писать и рассматривать по-другому – НОН. То есть вода состоит из двух частей (ионов): положительно заряженной частицы – катиона водорода Н + , и отрицательно заряженной частицы – гидроксид-аниона ОН — . Если среда нейтральная, то ни одна из частиц не доминирует. Их количество (концентрация) равны. Ученые точно подсчитали это значение 10 -7 . Это очень маленькая величина, меньше единицы в 10 000 000 (10 миллионов раз). И как это подсчитать? Датский химик Сёренсен ввёл понятие для точной числовой характеристики среды раствора pH — водородный показатель. Это отрицательный десятичный логарифм концентрации водорода. Опять непонятно! То, что было записано как 10 -7 , стало просто числом 7. Вот это другое дело!
Водородный показатель рН принимает значения от 0 до 14. Чем больше значение, тем меньше количества катионов водорода.
А что насчет второй половины воды – группы ОН?
Представьте себе весы, на чашах которых находятся ионы Н + и ОН — (приложение 2). Чем больше катионов водорода, тем ниже опускается чаша (как будто лифт вниз по этажам). При этом чаша с гидроксид-анионами поднимается вверх, так как их количество уменьшается.
Как только баланс между Н + и ОН — нарушается, среда перестает быть нейтральной. Если больше частиц Н + , то среда будет кислая, если больше гидроксид-анионов ОН — , то щелочная. При любом раскладе их сумма должна быть равной 14.
Источник
Исследовательская работа «Индикаторы. Применение индикаторов. Природные индикаторы»

Актуальность моей работы заключается в том, что свойства растительных объектов могут быть использованы для применения в разных областях науки, например, таких как химия.
- Формировать представление о природных индикаторах.
- Исследовать их свойства.
- Изучить действие химических и природных индикаторов в различных средах растворов.
Растворы растительных индикаторов можно использовать в качестве кислотно-основных индикаторов для определения среды различных растворов на уроках химии и в домашних условиях.
- Изучить понятие – индикаторы;
- Рассмотреть классификацию индикаторов;
- Сделать определенные выводы по применению индикаторов в быту и природе;
- Исследовать как индикаторы меняют свою структуру;
- Научиться выделять индикаторы из природного сырья;
- Исследовать действие природных индикаторов в различных средах.
- Ознакомиться с классификацией индикаторов;
- Выделить индикаторы из природного сырья;
- Исследовать, как природные индикаторы меняют свою структуру в различных средах.
- Изучить понятие – индикатор;
- Ознакомиться с классификацией индикаторов ;
- Приготовить раствор;
- Исследовать действие природных индикаторов в различных средах;
- Сделать выводы.
Индикаторы – вещества позволяющие следить за составом среды или за протеканием химической реакции. Одни из самых распространённых – кислотно-основные индикаторы, которые изменяют цвет в зависимости от кислотности раствора.
История открытия индикаторов
Впервые индикаторы обнаружил в 17 веке английский физик и химик Роберт Бойль .
Роберт Бойль — англо-ирландский химик, физик, богослов и натурфилософ. Один из учредителей Лондонского королевского общества. Роберт Бойль родился 25 января 1627 года в городе Лисмор, Ирландия. В 1635-1638 гг. Бойль учился в Итонском колледже, а в 1639-1644 гг. – в Женевской академии. С 1654 года, переселившись в Оксфорд, обратился к исследованиям в области химии и физики, приняв участие в работах научного общества. В 1660 г. по его инициативе было создано Лондонское королевское общество. Роберт Бойль умер 31 декабря 1691 года в Лондоне.
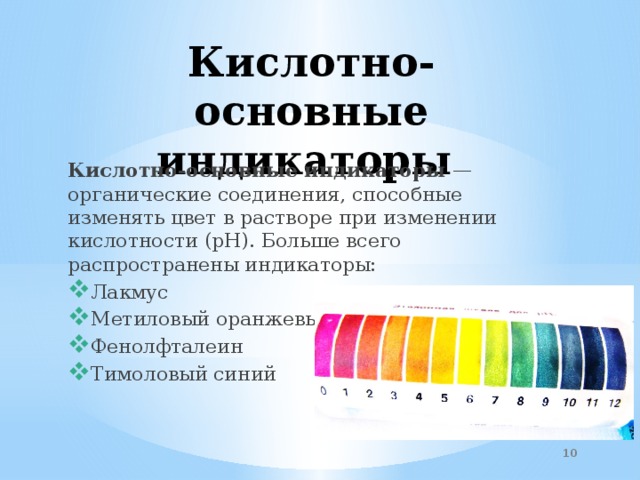
Кислотно-основные индикаторы
Кислотно-основные индикаторы — органические соединения, способные изменять цвет в растворе при изменении кислотности (pH). Больше всего распространены индикаторы:
Изменение окраски индикаторов в зависимости от среды
Источник