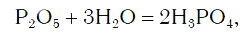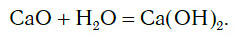- Урок 31. Оксиды
- Состав оксидов
- Классификация оксидов
- Оксиды в природе
- 1. Общая характеристика оксидов
- Урок 19. Соединения элементов с кислородом
- Оксиды — сложные вещества
- Название оксидов
- Оксиды в природе
- Какие известные оксиды встречающиеся в природе?
- Где и в каком виде предельные углеводороды встречаются в природе?
- В каком виде железо встречается в природе?
- В виде каких соединений хлор встречается в природе?
- Какие металлы встречаются в природе только в соединениях?
- В виде каких соединений встречаются в природе : P, S, N?
- Какие соединения серы встречаются в природе, где и как образуются?
- Назовите, в виде каких соединений хлор встречается в природе?
- Какие кислоты встречаются в природе?
- В каком виде встречаются металлы в природе?
- Какое соединение Al не встречается в природе?
Урок 31. Оксиды
В уроке 31 «Оксиды» из курса «Химия для чайников» познакомимся с оксидами их классификацией, а также узнаем где они встречаются в природе.
Все неорганические вещества делятся на несколько классов, важнейшими из которых являются оксиды, кислоты, основания и соли. Первоначальные сведения об этих веществах вы уже получили. Теперь вам предстоит познакомиться с ними более подробно и систематизировать свои знания.
Вы уже знаете, что самым распространенным элементом на Земле является кислород. Его атомы, соединяясь с атомами других элементов, образуют огромное количество сложных неорганических веществ, среди которых важное место занимают оксиды.
Состав оксидов
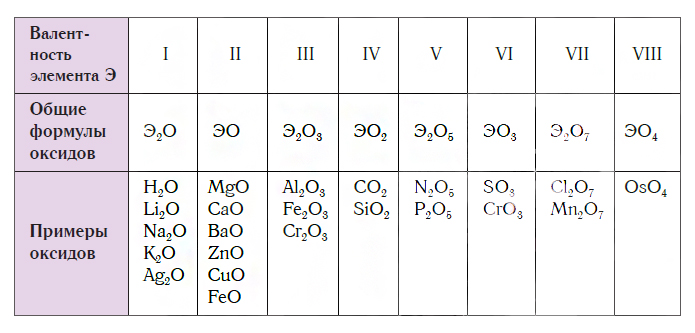
В состав любого оксида входят атомы двух химических элементов, один из которых — кислород, например: Н2О, Al2O3, Р2О5, CuO, Cl2O7. Всего известно около трехсот разных оксидов. Их общая химическая формула — ЭxOy, где буква Э обозначает символ химического элемента, образующего оксид, О — символ кислорода, а буквы x и y — индексы, обозначающие число атомов в молекулах или в формульных единицах оксидов.
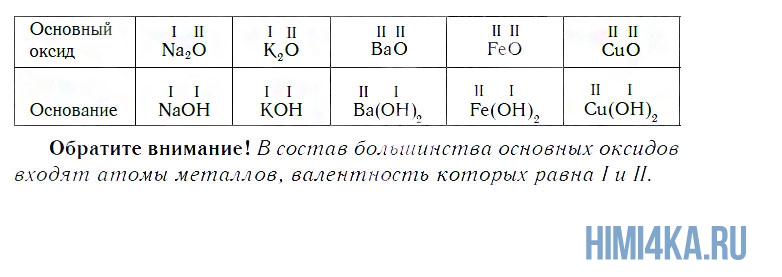
Поскольку валентность атомов кислорода в оксидах всегда равна II, а валентность атомов других элементов принимает значения от I до VIII, состав оксидов выражается формулами, приведенными в следующей таблице.
Классификация оксидов
Поскольку оксидов известно очень много, возникает необходимость классификации этих веществ по их химическим свойствам, т. е. по способности превращаться в другие вещества.
Вы уже знаете, что оксиды могут реагировать с водой, превращаясь при этом в соединения двух типов — кислоты и основания. Так, например, оксид фосфора(V) P2O5, присоединяя воду, превращается в кислоту H3PO4:
а оксид кальция CaO, взаимодействуя с водой, превращается в основание Ca(OH)2:
Иначе говоря, оксиду фосфора соответствует кислота, а оксиду кальция соответствует основание. Исходя из этого, оксиды можно разделить на две большие группы — кислотные и основные оксиды.
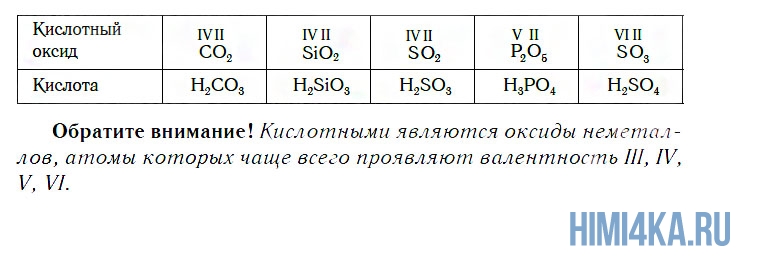
К кислотным относятся оксиды, которым соответствуют кислоты. Наряду с Р2О5, кислотными являются также оксиды: CO2, SiO2, SO2, N2O5, SO3 и некоторые другие. Всем им соответствуют кислоты.
К основным относятся оксиды, которым соответствуют основания. Кроме СaO, основными являются оксиды: Na2O, K2O, BaO, FeO, CuO и ряд других. Всем этим оксидам соответствуют основания.
Оксиды в природе
Оксиды содержатся в каждой из трех оболочек нашей планеты — в атмосфере, гидросфере, литосфере.
Самым распространенным оксидом в атмосфере и гидросфере является вода H2O, а в литосфере — оксид кремния(IV) SiO2, встречающийся в виде красивых кристаллов кварца (рис. 116) и кварцевого песка.
Краткие выводы урока:
- Оксиды делятся на кислотные и основные. Кислотным оксидам соответствуют кислоты, а основным — основания.
- Оксиды широко распространены в природе.
Надеюсь урок 31 «Оксиды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник
1. Общая характеристика оксидов
Оксидами называют сложные вещества, состоящие из двух химических элементов, одним из которых является кислород.
Оксиды — весьма распространённый в природе класс соединений. Они находятся в воздухе, распространены в гидросфере и литосфере.
На Земле вода встречается во всех трёх агрегатных состояниях — газообразном (водяной пар), жидком и твёрдом (лёд, снег). На долю воды также приходится большая часть массы живых организмов.
Примесь этого очень ядовитого вещества может содержаться в воздухе. Основным источником загрязнения является транспорт. Угарный газ образуется в результате неполного сгорания топлива. Этот же оксид образуется и во время пожаров.
В природе этот оксид встречается в виде минерала гематита. Он составляет основу руды, называемой красным железняком.
Оксиды принято группировать в зависимости от их способности реагировать с кислотами и основаниями. Различают три важнейшие группы оксидов: основные, кислотные и амфотерные. Их относят к солеобразующим оксидам. Существуют также оксиды, которые называют несолеобразующими.
Основные оксиды образуются химическими элементами — металлами. Как правило, степень окисления элемента, образующего основный оксид, является невысокой: \(+1\) или \(+2\).
Кислотные оксиды образуют элементы — неметаллы. Например, оксид серы(\(VI\)) SO 3 , оксид азота(\(IV\)) NO 2 .
Также кислотные оксиды могут быть образованы металлическими химическими элементами, в которых те проявляют степень окисления от \(+5\) до \(+7\). Например, оксид хрома(\(VI\)) Cr O 3 и оксид марганца(\(VII\)) Mn 2 O 7 .
Если металлический элемент имеет переменную валентность (проявляет несколько степеней окисления), то из всех образуемых им оксидов амфотерными свойствами обладают те, в которых этот элемент имеет промежуточную валентность (промежуточную степень окисления).
К ним относятся: оксид углерода(\(II\)) CO , оксид кремния(\(II\)) SiO ,оксид азота(\(I\)) N 2 O , оксид азота(\(II\)) NO .
В соответствии с номенклатурой ИЮПАК, оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже.
Если элемент, образующий оксид, имеет переменную степень окисления (или валентность), то в названии оксида указывается его степень окисления римской цифрой в скобках сразу после названия (без пробела).
Например: Cu 2 O — оксид меди(\(I\)), CuO — оксид меди(\(II\)), FeO — оксид железа(\(II\)), Fe 2 O 3 — оксид железа(\(III\)), Cl 2 O 7 — оксид хлора(\(VII\)).
Часто используют и другие наименования оксидов по числу атомов кислорода: если оксид содержит только один атом кислорода, то его называют монооксидом, или моноокисью, если два — диоксидом, или двуокисью, если три — то триоксидом, или трёхокисью и т. д.
Также распространены исторически сложившиеся (тривиальные) названия оксидов, например, угарный газ CO , серный ангидрид SO 3 и т. д.
Источник
Урок 19. Соединения элементов с кислородом
В уроке 19 «Соединения элементов с кислородом» из курса «Химия для чайников» узнаем, что из себя представляют сложные вещества — оксиды; узнаем, как правильно называть оксиды и где они встречаются в природе.
Большинство веществ относится к сложным веществам, каждое из которых принадлежит к одному из известных классов. Знакомство с ними мы начнем с самого простого класса неорганических веществ — оксидов.
Оксиды — сложные вещества
В состав многих сложных химических веществ входят атомы только двух химических элементов, одним из которых является кислород. В составе сложных веществ атомы кислорода всегда проявляют валентность, равную II. Например: SiO2, CuO, CaO, Al2O3 и др. Такие сложные вещества называют оксидами.
Оксиды — сложные вещества, состоящие из атомов двух химических элементов, один из которых — кислород.
Продуктами реакции в рассмотренных нами процессах горения простых и сложных веществ в кислороде являются оксиды: H2O, CO2, SO2, P2O5 и Fe3O4.
При обычных условиях оксиды (рис. 85) различных элементов могут находиться в жидком (H2O), твердом (CaO) и газообразном (CO2) состояниях. Они могут иметь самую разную окраску (белые CaO, Al2O3, черные CuO, Ag2O, красный HgO, коричневый Fe2O3) и различаться другими физическими свойствами.
Как следует из приведенных примеров, в состав оксидов входит различное число атомов кислорода и другого элемента. Почему так происходит? Как вы знаете, атомы соединяются в химические соединения согласно их валентностям. Как правильно составить химическую формулу бинарного соединения, вы также знаете.
Название оксидов
Известно очень много оксидов самых разных элементов. Каждый из них имеет свою химическую формулу и название. Название оксида образуется из слова оксид и названия химического элемента. Например, оксид магния — MgO, оксид натрия — Na2O, оксид водорода — H2O. Если атомы химического элемента проявляют переменную валентность, то после названия этого элемента в круглых скобках следует указать римскую цифру, показывающую валентность этого химического элемента в данном оксиде. Например, оксид серы(IV) — SO2, оксид серы(VI) — SO3, оксид железа(III) — Fe2O3, оксид фосфора(V) — P2O5.
Оксиды в природе
Оксиды широко распространены в окружающей нас природе. Представьте себе, сколько воды содержится во всех морях, океанах и реках. А ведь это все — оксид водорода H2O, он же — обычная вода. Другой очень распространенный оксид, с которым мы каждый день встречаемся, — оксид кремния(IV) SiO2, или обычный песок. В выдыхаемом нами воздухе содержится оксид углерода(IV) CO2, или углекислый газ.
Многие оксиды встречаются в земной коре в виде минералов.
Краткие выводы урока:
- В результате реакции горения простых и сложных веществ в кислороде образуются оксиды.
- Оксиды — сложные вещества, состоящие из атомов двух химических элементов, одним из которых является кислород.
- Название оксида образуется из слова «оксид» и названия химического элемента.
Надеюсь урок 19 «Соединения элементов с кислородом» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник
Какие известные оксиды встречающиеся в природе?
Где и в каком виде предельные углеводороды встречаются в природе?
Где и в каком виде предельные углеводороды встречаются в природе.
В каком виде железо встречается в природе?
В каком виде железо встречается в природе.
В виде каких соединений хлор встречается в природе?
В виде каких соединений хлор встречается в природе?
Какие металлы встречаются в природе только в соединениях?
Какие металлы встречаются в природе только в соединениях.
В виде каких соединений встречаются в природе : P, S, N?
В виде каких соединений встречаются в природе : P, S, N.
Какие соединения серы встречаются в природе, где и как образуются?
Какие соединения серы встречаются в природе, где и как образуются?
Назовите, в виде каких соединений хлор встречается в природе?
Назовите, в виде каких соединений хлор встречается в природе?
Какие кислоты встречаются в природе?
Какие кислоты встречаются в природе?
В каком виде встречаются металлы в природе?
В каком виде встречаются металлы в природе?
Какое соединение Al не встречается в природе?
Какое соединение Al не встречается в природе.
На этой странице сайта размещен вопрос Какие известные оксиды встречающиеся в природе? из категории Химия с правильным ответом на него. Уровень сложности вопроса соответствует знаниям учеников 10 — 11 классов. Здесь же находятся ответы по заданному поиску, которые вы найдете с помощью автоматической системы. Одновременно с ответом на ваш вопрос показаны другие, похожие варианты по заданной теме. На этой странице можно обсудить все варианты ответов с другими пользователями сайта и получить от них наиболее полную подсказку.
Я про алюминийАлюминий – легкий, прочный и пластичный металл. Это один из самых востребованных металлов, и по темпам роста потребления он давно и с большим отрывом оставил позади сталь, никель, медь и цинк. Алюминий без преувеличений можно назвать ..
Тому що рН показує ступінь концентрації катіонів гідрогену у воді, що є дуже важливим для косметики.
1. дано N(NH3) = 4. 816 * 10 ^ 23 — — — — — — — — — — — — — — — — — — — — — — — — — — — — — V(NH3) — ? N(NH3) / N(A) = V(NH3) / Vm V(NH3) = N(NH3) * Vm / N(A) = 4. 816 * 10 ^ 23 * 22. 4 / 6. 02 * 10 ^ 23 = 15. 58 L ответ 15. 58 л 2) дано m(O2)..
Соотвественно правильным ответом будет являться : 4) KCl ; 5) AgCl ; 6) NH4Cl.
Дано W(O) = 47 % — — — — — — — — — — — — — — — — E — ? Е — это неизвестный элемент W(O) = Ar(O) * n / M(X2O3) * 100% 47% = 16 * 3 / 2x + 48 * 100% 94x + 2256 = 4800 X = 27 — это алюминий Al2O3 ответ алюминий.
Напиши нормально не понятно или сфоткай.
В SO3 32 / (32 + 3 * 16) = 0, 4 или 40 %.
Реакции есть на фотографии.
4HCl + MnO2 = MnCl2 + Cl2 + 2H2O соляная кислота отдаёт в свободном виде половину имеющегося хлора. M(Cl общ. ) = 1000 * 0, 365 * 0, 9726 = 355 г масса выделившегося хлора = 355 / 2 = 177, 5 г.
Типы химической реакции соединение, разложение замещение.
© 2000-2023. При полном или частичном использовании материалов ссылка обязательна. 16+
Сайт защищён технологией reCAPTCHA, к которой применяются Политика конфиденциальности и Условия использования от Google.
Источник