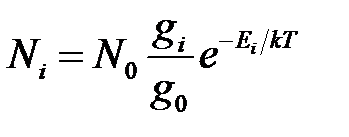Спектры излучения и поглощения атомов. Спектральный анализ.
Теория Бора позволила объяснить существование линейчатых спектров. Спектр излучения (или поглощения) — это набор волн определенных частот, которые излучает (или поглощает) атом данного вещества. Спектры бывают сплошные, линейчатые и полосатые. Сплошные спектры излучают все вещества, находящиеся в твердом или жидком состоянии. Сплошной спектр содержит волны всех частот видимого света и поэтому выглядит как цветная полоса с плавным переходом от одного цвета к другому в таком порядке: красный, оранжевый, желтый, зеленый, синий и фиолетовый (каждый охотник желает знать, где сидит фазан). Линейчатые спектры излучают все вещества в атомарном состоянии. Атомы всех веществ излучают свойственные только им наборы волн вполне определенных частот. Как у каждого человека свои личные отпечатки пальцев, так и у атома данного вещества свой, характерный только ему спектр. Линейчатые спектры излучения выглядят как цветные линии, разделенные промежутками. Природа линейчатых спектров объясняется тем, что у атомов конкретного вещества существуют только ему свойственные стационарные состояния со своей характерной энергией, а следовательно, и свой набор пар энергетических уровней, которые может менять атом, т. е. электрон в атоме может переходить только с одних определенных орбит на другие, вполне определенные орбиты для данного химического вещества. Полосатые спектры излучаются молекулами. Выглядят полосатые спектры подобно линейчатым, только вместо отдельных линий наблюдаются отдельные серии линий, воспринимаемые как отдельные полосы. Характерным является то, что какой спектр излучается данными атомами, такой же и поглощается, т. е. спектры излучения по набору излучаемых частот совпадают со спектрами поглощения. Поскольку атомам разных веществ соответствуют свойственные только им спектры, то существует способ определения химического состава вещества методом изучения его спектров. Этот способ называется спектральным анализом. Спектральный анализ применяется для определения химического состава ископаемых руд при добыче полезных ископаемых, для определения химического состава звезд, атмосфер, планет; является основным методом контроля состава вещества в металлургии и машиностроении.
Спектральный анализ — совокупность методов качественного и количественного определения состава объекта, основанная на изучении спектров взаимодействия материи с излучением, включая спектры электромагнитного излучения, акустических волн, распределения по массам и энергиям элементарных частиц и др. В зависимости от целей анализа и типов спектров выделяют несколько методов спектрального анализа. Атомный и молекулярный спектральный анализы позволяют определять элементный и молекулярный состав вещества, соответственно. В эмиссионном и абсорбционном методах состав определяется по спектрам испускания и поглощения. Масс-спектрометрический анализ осуществляется по спектрам масс атомарных или молекулярных ионов и позволяет определять изотопный состав объекта.
- Современные представления о строении атомов. Квантово-механическое описание. Квантово-механическая модель атома. Современная модель атома является развитием планетарной модели. Согласно этой модели, ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько-нибудь определённым траекториям (неопределённость координаты электрона в атоме может быть сравнима с размерами самого атома).
Химические свойства атомов определяются конфигурацией электронной оболочки и описываются квантовой механикой. Положение атома в таблице Менделеева определяется электрическим зарядом его ядра (то есть количеством протонов), в то время как количество нейтронов принципиально не влияет на химические свойства; при этом нейтронов в ядре, как правило, больше, чем протонов (см.: атомное ядро). Если атом находится в нейтральном состоянии, то количество электронов в нём равно количеству протонов. Основная масса атома сосредоточена в ядре, а массовая доля электронов в общей массе атома незначительна
Источник
Происхождение атомных эмиссионных спектров
Атомы и ионы всех химических элементов могут находиться в нормальном (основном) и возбужденном состояниях. В нормальном состоянии атомы обладают минимальной энергией Е 0 и в этом состоянии не излучают. Под влиянием внешних воздействий (высокая температура, столкновение с быстролетящими частицами) атомы получают дополнительную энергию и переходят в возбужденное состояние, при этом происходит переход преимущественно валентных электронов с нормального энергетического уровня Е 0 на более высокий Еi:
| B E 0 |
| B * |
| B |
| Ei |
| hν 1 |
| hν 2 |
| hν 3 |
где h – постоянная Планка; ν – частота излучения; с – скорость света; l – длина волны излучения.
По истечении очень короткого времени (~10 –8 с) каждый возбужденный атом самопроизвольно (спонтанно) возвращается в нормальное состояние (или какое-либо устойчивое промежуточное), при этом избыточная энергия излучается в виде квантов света hνi.
Каждый переход электрона с возбужденного энергетического уровня на устойчивое состояние с меньшей энергией сопровождается излучением кванта света, но так как в излучении принимают участие много атомов с различными начальными энергиями и переход возбужденных электронов осуществляется на различные устойчивые состояния, то энергия и длины волн излучаемых квантов тоже различные. У каждого элемента наблюдается своя совокупность (S hc/li) квантов света с различными длинами волн.
При разложении испускаемого излучения по длинам волн в наблюдаемых (или фотографируемых) спектрах каждому электронному переходу соответствует определенная линия, а сам спектр называется линейчатым. Положение линий в спектре элемента определяется только природой химического элемента и не зависит от его концентрации. Число линий в спектре определяется числом электронных переходов, преимущественно валентных электронов. Так как энергия излучаемых квантов элемента различная, то и интенсивность линий в спектре тоже различная.
Наиболее яркие линии в спектре элемента называют аналитическими. Самые интенсивные (яркие) линии в спектрах элементов наблюдаются при переходах электронов с самого нижнего возбужденного уровня на основной. Такие линии называют резонансными. Одним из наиболее замечательных свойств атомных спектров является их дискретность (т.е. линейчатая структура) и сугубо индивидуальный характер, что делает такие спектры опознавательным признаком каждого элемента. То есть атомный эмиссионный спектр каждого химического элемента характеризуется только ему свойственной комбинацией спектральных линий. На этом основан качественный анализ. Количественное же определение элементов основано на измерении интенсивности квантов излучения по наиболее ярким аналитическим линиям в спектрах элементов.
В плазме возбужденные и невозбужденные атомы находятся в термодинамическом равновесии в соответствии с законом Больцмана:
,
где Ni и N 0 – концентрации атомов в возбужденном и основном состояниях, соответственно; gi и g 0 – статистические веса этих состояний; Ei – энергия возбужденного уровня i, эВ; Т – абсолютная температура.
Интенсивность спектральной линии, соответствующей переходу электрона с i -го уровня на основной, описывается выражением:
где Ai 0 – вероятность спонтанного перехода электрона с уровня i на основной; h – постоянная Планка; ν – частота излучения, с –1 .
При постоянной температуре Т число возбужденных атомов Ni пропорционально числу атомов N 0, т.е. фактически общему числу атомов в плазме атомизатора. Интенсивность спектральных линий возрастает пропорционально концентрации N 0 невозбужденных атомов в плазме, а, следовательно, и концентрации элемента в пробе, но только в области малых концентраций. При более высоких концентрациях атомов пропорциональная зависимость интенсивности линий от N 0 нарушается вследствие эффекта самопоглощении испускаемого излучения плазмой. Влияние самопоглощения в наибольшей степени проявляется при резонансных переходах, так как в этом случае фотоны поглощаются атомами, находящимися в основном (невозбужденном) состоянии, которые преобладают в плазме (Ni N 0). Тем не менее, для достаточно широкого интервала концентраций элемента в пробе зависимость интенсивности I спектральной линии от концентрации с элемента в анализируемой пробе можно выразить эмпирическим уравнением Ломакина-Шайбе:
где а – коэффициент, зависящий от свойств источника возбуждения и пробы; b – коэффициент, учитывающий самопоглощение излучения в плазме атомизатора.
К сожалению, самопоглощение излучения не единственная помеха в проведении АЭСА. При электронных переходах с близкими энергиями существует вероятность наложения спектральных линий при их уширении. Ширина спектральной линии увеличивается с ростом ее интенсивности. Кроме того, на ширину спектральной линии оказывают влияние и другие факторы – это естественное уширение, обусловленное конечным «временем жизни» возбужденного состояния (10 –4 –10 –5 нм), доплеровское уширение, обусловленное хаотическим тепловым движением атома (Δl≈10 –3 нм), лоренцевское (ударное) уширение, обусловленное столкновениями с другими атомами (Δl≈10 –3 нм). Однако, уширение линий в эмиссионных спектрах атомов с учетом влияния всех возможных факторов, как правило, не превышает величины Δl≈10 –3 нм, что практически не влияет на положение аналитических линий в спектрах элементов.
Если в анализируемом образце содержится несколько элементов, то для получения аналитической информации следует выбирать такие участки спектра, где аналитические линии элементов не перекрываются. Аналогично поступают, когда проявляется заметное влияние сопутствующего фона. Среди физико-химических помех, влияющих на интенсивность спектральных линий, следует отметить также неполноту атомизации пробы и ионизацию атомов, которые уменьшают концентрацию N 0 «атомного пара» в плазме и, в конечном счете, уменьшают концентрацию Ni возбужденных атомов, формирующих аналитический сигнал.
Для подавления физико-химических помех и поддержания постоянства температуры применяют так называемые спектроскопические буферы. Для уменьшения образования труднодиссоциирующих оксидов вводят в плазму соединения металлов, образующих более прочные оксиды, а ионизацию атомов определяемых элементов подавляют введением в пробу щелочных металлов с низкими потенциалами ионизации, например, К (Е ион.=4.34 эВ), Na (Е ион.=5.14 эВ).
Источник
Происхождение атомных спектров
При изменении хотя бы одного квантового числа атом получает или отдает энергию. Это может произойти при взаимодействии атома с ЭМИ, при непосредственном обмене энергией с другими атомами, например, при столкновениях или при химических реакциях. В отсутствии внешних воздействий атом находится в основном состоянии, т.е. обладает наименьшей энергией. При получении энергии извне атом возбуждается.
Рис. 11. Энергетические переходы в атоме
Атом не может получить или отдать любое количество энергии. Энергетический обмен осуществляется только конечными порциями, в частности квантами ЭМИ, т.е. атом может находится друг от друга на конечную величину.
Один атом за один акт поглощает или испускает только один фотон с определенной энергией. Вещество состоит из множества одинаковых атомов, способных переходить на разные энергетические уровни, выпуская или поглощая кванты разных частот. Совокупность всех фотонов одной и той же частоты составляет спектральную линию, при поглощении ее называют абсорбционной, при испускании — эмиссионной. Совокупность всех абсорбционных или всех эмиссионных линий называют абсорбционным или эмиссионным спектром вещества.
Спектр поглощения получают, помещая исследуемое вещество в поток ЭМИ, а для получения спектра испускания атомы вещества предварительно переводят в возбужденное состояние, что достигается подведением какой-либо энергии (тепловой, химической, электроразряда и т.п.). После возбуждения атомы через 10 -9 – 10 -7 с возвращаются в основное состояние, испуская фотоны.
Частота испускаемого или поглощаемого излучения определяется разностью энергии между электронными орбиталями ΔЕ:
Внешние легковозбудимые электроны называют оптическими, переходы с их участием дают оптический спектр. Наиболее вероятны переходы с первого возбужденного уровня на основной Е0, соответствующие им спектральные линии называют резонансными. Поскольку интенсивность линии пропорциональна числу фотонов в секунду, то более частым переходам соответствует интенсивная линия, а редким — менее интенсивная. Наиболее интенсивны резонансные линии, так как вероятность перехода Е1→Е0 очень велика.
Испускание — самопроизвольный процесс, так как атом всегда стремится перейти из нестабильного состояния, возбужденного, в более стабильное состояние с меньшей энергией. Поглощение — вынужденный процесс, увеличивающий энергию атома за счет поглощаемого фотона.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник