2.Кристаллическое строение металлов
Твердые тела делят на: кристаллические и аморфные.
Кристалические тела при нагреве остаются твердыми до определенной температуры (температуры плавления), при которой они переходят в жидкое состояние. При охлаждении жидкого металла процесс идет в обратном направлении.
Аморфные тела при нагреве размягчаются в большем температурном интервале; сначала они становятся вязкими и лишь затем переходят в жидкое состояние. При охлаждении процесс идет в обратном направлении. Таким характерным свойством, например, обладает стекло, пластмассы.
Все металлы и их сплавы — тела кристаллические. Единственный металл, находится в жидком состоянии при обычных температурных условиях (комнатной температуре) – ртуть.
Кристаллическое состояние твердого тела более стабильно, чем аморфное. В результате длительной выдержки при температуре, а в некоторых случаях при деформации, нестабильность аморфного состояния проявляется в частичной или полной кристаллизации. Пример – помутнение неорганического стекла при нагреве.
Кристалл – атомная структура, состоящая из атомов, зафиксированных друг относительно друга. Особенность кристаллов – упорядоченное строение.
Места расположения атомов – узлы кристаллической решетки.
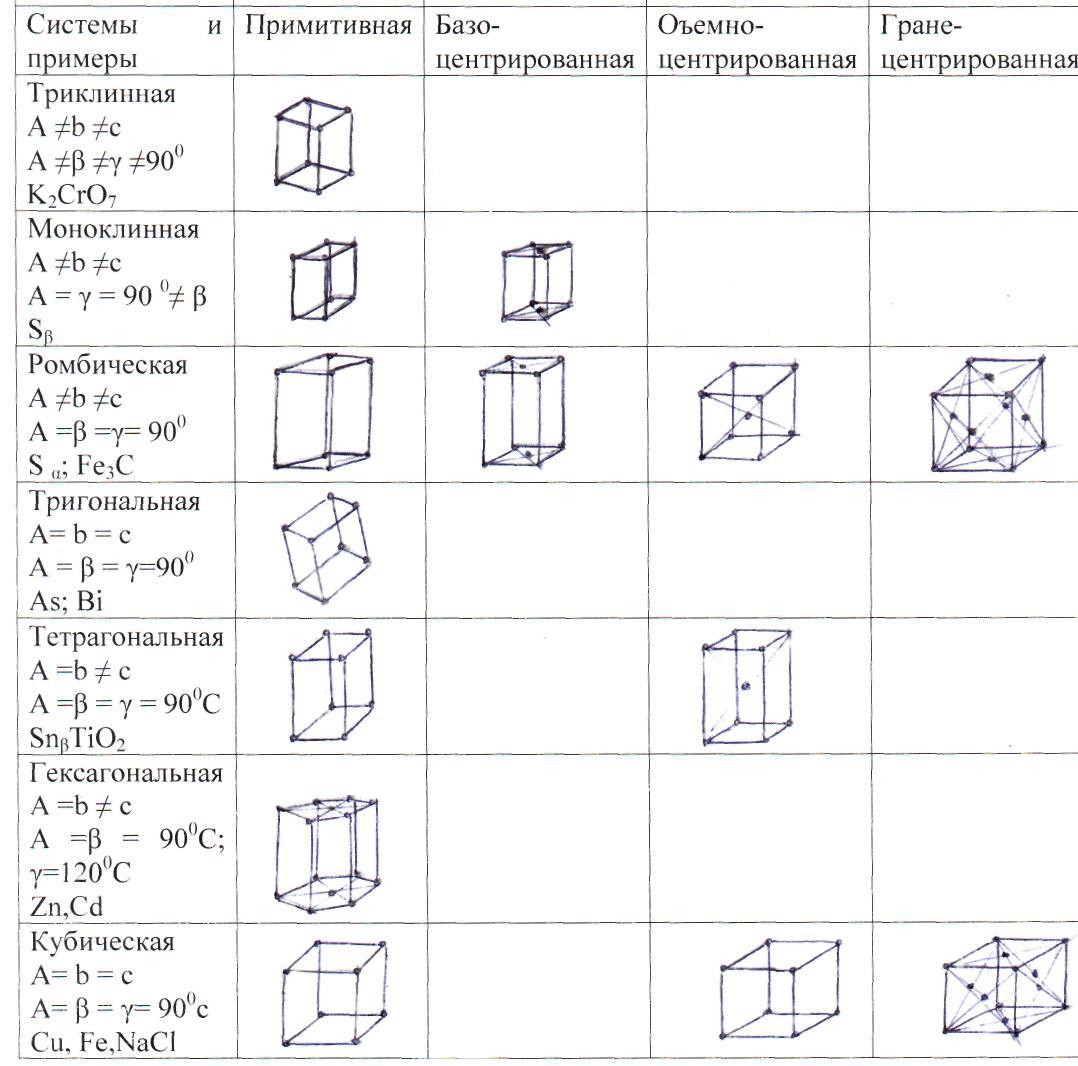
Ячейка кристаллической решетки – группа атомов, упорядоченно расположенных друг относительно друга и периодически повторяющихся в кристалле по всем направлениям. В зависимости от расположения атомов в ячейке различают различные типы кристаллических решеток. Всего типов решеток – 14, табл. 1.1.
Формирование кристаллической решетки в металле происходит следующим образом. При переходе металла из жидкого в твердое состояние расстояние между атомами сокращается, а силы взаимодействия между ними возрастают. Характер взаимодействия атомов определяется строением их внешних электронных оболочек. При сближении атомов электроны, находящиеся на внешних оболочках, теряют связь со своими атомами вследствие отрыва валентного электрона одного атома положительно заряженным ядром другого и т. д. Происходит образование свободных электронов, так как они не принадлежат отдельным атомам. Таким образом, в твердом состоянии металл представляет собой структуру, состоящую из положительно заряженных ионов, омываемых свободными электронами
Связь в металле осуществляется электростатическими силами.
Между частицами в кристалле существуют различные типы связи. Тип связи определяется электронным строением атомов, вступающих во взаимодействие. Элементарные частицы сближаются на определенное расстояние, которое обеспечивает наибольшую термодинамическую стабильность — минимум энергии связи.
Энергия связи определяет физические свойства материалов. Все кристаллы по характеру связи условно подразделяют на: молекулярные, ковалентные, металлические и ионные, но такое деление условно, т.к. может действовать и несколько типов связи: молекулярные; ковалентные; металлические; ионные.
Молекулярные кристаллы — это кристаллы, в которых преобладает связь Ван-дер-Ваальса. Например, в кристаллах инертных газов при очень низких температурах и больших давлениях (твердое состояние) при сближении атомов обмен электронами невозможен, силы притяжения между ними объясняются мгновенной поляризацией атомов при сближении. При нормальных условиях к молекулярным относятся кристаллы J2, H2O, CO2, CH4. Для этих кристаллов характерна наиболее компактная кристаллическая решетка – ГЦК (гранецентрированная). Энергия связи невелика, поэтому кристаллические тела с молекулярным типом связи имеют низкие температуры плавления и испарения, большие температурные коэффициенты линейного расширения, обладают диэлектрическими свойствами.
Ковалентные кристаллы – это кристаллы, у которых преобладает ковалентный тип связи. Такие кристаллы образуют элементы 4, 5, 6 подгруппы в периодической системы. Атомы обобществляют свои валентные электроны с соседними атомами, достраивая валентную зону. Пример: углерод, кремний, германий, сурьма, висмут и др. Для этих материалов характерна направленность межатомных связей и неплотноупакованные кристаллические структуры. Материалы с ковалентным типом связи обладают низкой пластичностью и высокой твердостью, имеют высокую температуру плавления, по электрическим свойствам относятся к полупроводникам и диэлектрикам.
Металлические кристаллы – это кристаллы, у которых преобладает металлический тип связи. Их образуют элементы всех подгрупп А и 1 — 3 подгрупп В. Валентные энергетические зоны перекрываются, образуя общую зону со свободными электронами в объеме всего кристалла. Пример: кристаллические структуры с ГЦК (гранецентрированная) — никель, серебро, медь, золото, железо — γ, платина, алюминий, свинец; с ГПУ (гексогональная плотноупакованная) — магний, кобальт, берилий, цинк, титан; с ОЦК (объемноцентрированная) — железо – α, хром, молибден, вольфрам, тантал.
Все физические, включая и прочностные, свойства металлов вдоль различных кристаллографических направлений зависят от числа атомов, расположенных на упомянутых направлениях.
В действительности в кристаллической решетке на различных напралениях находится разное число атомов. Например, в кубических решетках (см. табл.1.1, табл. 1.2) вдоль диагоналей куба ОЦК решетки [111] или диагоналей граней решетки ГЦК [110], [101], [011] размещается больше атомов, чем по направлениям вдоль ребер кубов [100], [010], [001].
Из сказанного следует, что в кристаллических веществах должна наблюдаться анизотропия, т. е. неодинаковость свойств вдоль различных кристаллографических направлений.
Таким образом, анизотропия является закономерным результатом упорядоченного расположения атомов в кристаллических телах. Анизотропия механических и других свойств наблюдается при испытании образцов, вырезанных вдоль различных кристаллографических направлений.
Наглядным и убедительным подтверждением наличия анизотропии является опыт с медным шаром, изготовленным из монокристалла. Если такой шар нагревать, то вследствие неодинаковости коэффициентов линейного расширения по различным направлениям он зримо утратит геометрически правильную форму шара и превратится в эллипсоид. Не всем свойствам кристаллических тел присуще явление анизотропии. Например, такое свойство, как теплоемкость, от направления не зависит.
Следует особо подчеркнуть, что анизотропия проявляется только в пределах одного кристаллического зерна, или монокристалла. Реальные металлы являются телами поликристаллическими, состоящими из огромного числа зерен, произвольно ориентированных друг к другу своими кристаллографическими направлениями и плоскостями.
В связи с этим недостаток какого-либо свойства по одному из направлений приложения силы в одних зернах компенсируется избытком этого свойства по этому же направлению в других зернах. Поэтому реальные металлы являются изотропными телами, т. е. телами с примерно одинаковыми свойствами по всем направлениям. Поскольку их изотропность является не истинной, а усредненной, то их принято называть квазиизотропными или псевдоизотропными телами.
Для элементов с металлическим типом связи (например железо, титан , олово и другие) имеет место явление полиморфизма — способность в твердом состоянии при различных температурах (или давлении) иметь различные типы кристаллических структур, которые называются аллотропическими формами или модификациями. Энергия металлической связи несколько меньше, чем энергия ковалентной связи, поэтому металлы, по сравнению с ковалентными кристаллами, имеют более низкие температуры плавления, испарения, меньший модуль упругости, но более высокий температурный коэффициент линейного расширения; металлы более пластичные и менее твердые; обладают хорошей электрической проводимостью. Так, ОЦК железо (α-железо), будучи нагрето до 911 0 С, перестраивает кристаллическую решетку и становится ГЦУ железом (γ- железо). Это строение сохраняется до 1392 0 С, после чего решетка снова перестраивается и приобретает ОЦК (β – железо) строение, сохраняя его вплоть до температуры плавления 1539 0 С.
Основоной причиной аллотропии является стремление любого вещества обладаить минимальным запасом свободной энергии Если у металла по достижении какой-о определенной температуры изменение типа кристаллической решетки обспечивает уменьшение запаса свободной энергии , то такой металл претерпевает аллотропическое превращение.
Начисие у металлов аллотропических (полиморфных) превращений имеет важноепрактическое значение, поскольку благодаря им у металлов изменяются такие свойства, как плотность, способность растворять в своей решетке другие элементы и т.д.
В связи с этим именно благодаря полиморфизму сплавы на основе железа, титана и других металлов можно подвергать термической обработке для целенаправленного изменения их свойств.
Ионные кристаллы – характерны для сложных кристаллов, состоящих из элементов различной валентности. Между элементами происходит перераспределение электронов, электроположительный элемент теряет свои валентные электроны и превращается в положительный ион, а электроотрицательный — приобретает, достраивая свою валентную зону до устойчивой конфигурации, как у инертных газов. Пример — кристалл оксида железа FeO, решетка которого состоит из отрицательно заряженных ионов кислорода и положительно заряженных ионов железа. Величина энергии связи кристаллов с ионным типом связи близка к ковалентным кристаллам и превышает металлические и тем более молекулярные. Имеют высокую температуру плавления и испарения, высокий модуль упругости и низкий коэффициент линейного расширения.
Плотность упаковки атомов в решетке определяется полным числом атомов, находящихся внутри объемного тела, образованного плоскостями, проходящими через центры внешних атомов ячейки, табл. 1.2.
Имеется определенная связь строения кристаллической решетки с механическими и физическими свойствами материала. От прочности связи зависит степень сопротивления деформации. От строения зависит способность к пластической деформации. Деформирование происходит за счет сдвига атомных плоскостей. Сдвиг происходит наиболее легко вдоль атомных плоскостей с наиболее плотной упаковкой атомов.
Рассмотрим объемно-центрическую кубическую решетку (ОЦК), рис. 1.5:
В плоскости ABGH плотность упаковки больше чем в ABСD. Наиболее вероятен сдвиг вдоль диагональных плоскостей.
Для характеристики элементарной ячейки задают шесть величин: три ребра ячейки а, в, с и три угла между ними α, β, γ (см. рис. 1.6). Эти величины называются параметрами элементарной ячейки или периодами кристаллической решетки.
Источник