Какую природу имеют силы взаимодействия молекул
Молекулярная физика — это просто!
Силы взаимодействия молекул
Все молекулы вещества взаимодействуют между собой силами притяжения и отталкивания.
Доказательство взаимодействия молекул: явление смачивания, сопротивление сжатию и растяжению, малая сжимаемость твердых тел и газов и др.
Причина взаимодействия молекул — это электромагнитные взаимодействия заряженных частиц в веществе.
Атом состоит из положительно заряженного ядра и отрицательно заряженной электронной оболочки. Заряд ядра равен суммарному заряду всех электронов, поэтому в целом атом электрически нейтрален.
Молекула, состоящая из одного или нескольких атомов, тоже электрически нейтральна.
Рассмотрим взаимодействие между молекулами на примере двух неподвижных молекул.
Между телами в природе могут существовать гравитационные и электромагнитные силы.
Так как массы молекул крайне малы, ничтожно малые силы гравитационного взаимодействия между молекулами можно не рассматривать.
На очень больших расстояниях электромагнитного взаимодействия между молекулами тоже нет.
Но, при уменьшении расстояния между молекулами молекулы начинают ориентироваться так, что их обращенные друг к другу стороны будут иметь разные по знаку заряды (в целом молекулы остаются нейтральными), и между молекулами возникают силы притяжения.
При еще большем уменьшении расстояния между молекулами возникают силы отталкивания, как результат взаимодействия отрицательно заряженных электронных оболочек атомов молекул.
В итоге на молекулу действует сумма сил притяжения и отталкивания. На больших расстояниях преобладает сила притяжения (на расстоянии 2-3 диаметров молекулы притяжение максимально), на малых расстояниях сила отталкивания.
Существует такое расстояние между молекулами, на котором силы притяжения становятся равными силам отталкивания. Такое положение молекул называется положением устойчивого равновесия.
Находящиеся на расстоянии друг от друга и связанные электромагнитными силами молекулы обладают потенциальной энергией.
В положении устойчивого равновесия потенциальная энергия молекул минимальна.
В веществе каждая молекула взаимодействует одновременно со многими соседними молекулами, что также влияет на величину минимальной потенциальной энергии молекул.
Кроме того, все молекулы вещества находятся в непрерывном движении, т.е. обладают кинетической энергией.
Таким образом, структура вещества и его свойства (твердых, жидких и газообразных тел) определяются соотношением между минимальной потенциальной энергией взаимодействия молекул и запасом кинетической энергии теплового движения молекул.
Строение и свойства твердых, жидких и газообразных тел
Строение тел объясняется взаимодействием частиц тела и характером их теплового движения.
Твердое тело
Твердые тела имеют постоянную форму и объем, практически несжимаемы.
Минимальная потенциальная энергия взаимодействия молекул больше кинетической энергии молекул.
Сильное взаимодействие частиц.
Тепловое движение молекул в твердом теле выражается только лишь колебаниями частиц (атомов, молекул) около положения устойчивого равновесия.
Из-за больших сил притяжения молекулы практически не могут менять свое положение в веществе, этим и объясняется неизменность объема и формы твердых тел.
Большинство твердых тел имеет упорядоченное в пространстве расположение частиц, которые образуют правильную кристаллическую решетку. Частицы вещества (атомы, молекулы, ионы) расположены в вершинах — узлах кристаллической решетки. Узлы кристаллической решетки совпадают с положением устойчивого равновесия частиц.
Такие твердые тела называются кристаллическими.
Жидкости имеют определенный объем, но не имеют своей формы, они принимают форму сосуда, в которой находятся.
Минимальная потенциальная энергия взаимодействия молекул сравнима с кинетической энергией молекул.
Слабое взаимодействие частиц.
Тепловое движение молекул в жидкости выражено колебаниями около положения устойчивого равновесия внутри объема, предоставленного молекуле ее соседями
Молекулы не могут свободно перемещаться по всему объему вещества, но возможны переходы молекул на соседние места. Этим объясняется текучесть жидкости, способность менять свою форму.
В жидкостях молекулы достаточно прочно связаны друг с другом силами притяжения, что объясняет неизменность объема жидкости.
В жидкости расстояние между молекулами равно приблизительно диаметру молекулы. При уменьшении расстояния между молекулами (сжимании жидкости) резко увеличиваются силы отталкивания, поэтому жидкости несжимаемы.
По своему строению и характеру теплового движения жидкости занимают промежуточное положение между твердыми телами и газами.
Хотя разница между жидкостью и газом значительно больше, чем между жидкостью и твердым телом. Например, при плавлении или кристаллизации объем тела изменяется во много раз меньше, чем при испарении или конденсации.
Газы не имеют постоянного объема и занимают весь объем сосуда, в котором они находятся.
Минимальная потенциальная энергия взаимодействия молекул меньше кинетической энергии молекул.
Частицы вещества практически не взаимодействуют.
Газы характеризуются полной беспорядочностью расположения и движения молекул.
Расстояние между молекулами газа во много раз больше размеров молекул. Малые силы притяжения не могут удержать молекулы друг около друга, поэтому газы могут неограниченно расширяться.
Газы легко сжимаются под действием внешнего давления, т.к. расстояния между молекулами велики, а силы взаимодействия пренебрежимо малы.
Давление газа на стенки сосуда создается ударами движущихся молекул газа.
Молекулярная физика. Термодинамика — Класс!ная физика
Источник
Силы взаимодействия молекул
Существование различных агрегатных состояний вещества объясняется тем, что между молекулами существуют силы притяжения и отталкивания. При изменении температуры баланс этих сил и энергии теплового движения изменяется, что и приводит к изменению состояния вещества. Кратко рассмотрим силы взаимодействия между молекулами.
Природа сил взаимодействия молекул
В 10 классе известно, что атомы всех элементов состоят из положительно заряженного ядра и отрицательно заряженных электронных оболочек вокруг. Взаимодействие электронных оболочек приводит к образованию молекул, состоящих из некоторого числа атомов.
Получается, что в любой молекуле существуют области, имеющие как положительный, так и отрицательный заряд. Распределение этих областей и создает силы, действующие на молекулы в данный момент времени, а с учетом изменения температуры оно определяет строение газообразных, жидких и твердых тел.
При этом природа этих сил всегда электростатическая. Впервые они были описаны в середине XIX в. Я. Ван-дер-Ваальсом. Поэтому нередко их называют ван-дер-ваальсовыми.
Виды межмолекулярных сил
Из-за того, что силы притяжения между молекулами изменяют пространственную ориентацию и форму самих молекул, они гораздо сильнее изменяются с изменением расстояния, как правило, пропорционально седьмой степени.
Это убывание гораздо быстрее, чем обычное кулоновское, пропорциональное квадрату расстоянию. Поэтому межмолекулярные силы играют значительную роль лишь на малых расстояниях.
По механизму их возникновения можно выделить следующие.
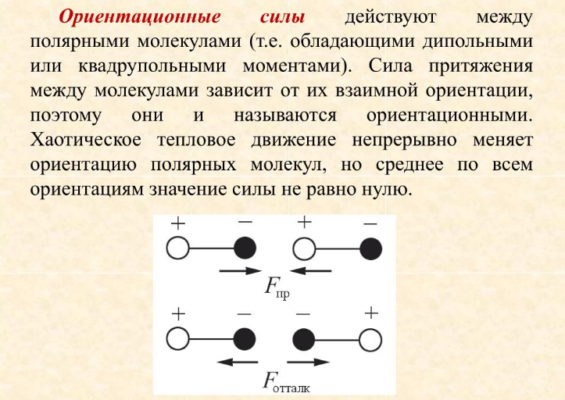
Ориентационные силы
Ориентационные силы еще называют дипольными. Они возникают в результате того, что многие молекулы представляют собой электрические диполи. Разноименные полюса диполей притягиваются, а одноименные — отталкиваются. В результате дипольные молекулы стремятся занять определенное пространственное положение друг относительно друга, что также влияет на величину сил.
В результате ориентационные силы прямо пропорциональны дипольным моментам молекул:
Поляризационные (индукционные) силы
Собственный дипольный момент молекул приводит к тому, что он наводит (индуцирует) небольшой дипольный момент у близлежащих молекул, немного «растягивая» их. Если близлежащие молекулы полярны, то индуцированный момент не играет большой роли по сравнению с собственным. Однако, если близлежащая молекула неполярна, то силы небольшого индуцированного момента будут заметны.
Сила взаимодействия будет пропорциональна дипольному моменту полярной молекулы и способности к поляризации под внешним воздействием неполярной молекулы (поляризуемости $\alpha$):
Дисперсионные силы
Поляризуемость неполярных молекул приводит к тому, что даже между ними возникают силы притяжения.
Хотя в среднем у неполярной молекулы дипольный момент отсутствует, в каждый конкретный момент времени электроны в электронном облаке могут иметь несимметричное положение. В результате мгновенный дипольный момент будет отличен от нуля. То же самое происходит и с соседними молекулами. Суммарное взаимодействие этих мгновенных дипольных моментов приводит к существованию сил притяжения, называемых дисперсионными.
Дисперсионные силы пропорциональны поляризуемостям взаимодействующих молекул:
Что мы узнали?
Силы взаимодействия молекул имеют электростатическую природу. Механизм их возникновения определяется существованием дипольных моментов у молекул. По виду эти силы делятся на ориентационные, поляризационные и дисперсионные. Их величина пропорциональная седьмой степени расстояния, поэтому они проявляются лишь на относительно небольших дистанциях.
Источник