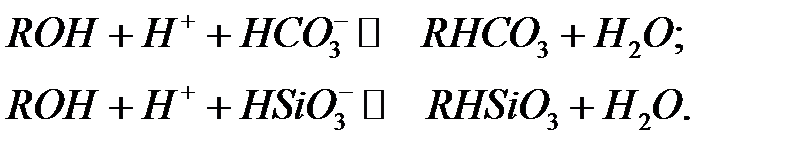1.2. Классификация, характеристика вод и их примесей
- пресную воду – солесодержание 1 г/дм 3 ;
- солоноватую – солесодержание 1–10 г/дм 3 ;
- соленую – солесодержание более 10 г/дм 3 ;
Большое распространение получила предложенная О.А. Алехиным система, по которой воды различаются по преобладающему в них аниону: гидрокарбонатный класс вод с преобладающим анионом 

Источник
1. Классификация примесей природных и сточных вод по фазово-дисперсному состоянию (по Кульскому).
Поверхностные, подземные, сточные (и все другие) воды, представляют собой сложные дисперсные системы, в которых присутствуют микрочастицы разных размеров, молекулярно растворенные вещества (в том числе газы), соединения, диссоциированные на ионы. Научно обосновать технологические приемы обработки воды позволяет классификация ее примесей, разработанная Л.А. Кульским, на основе их фазового состояния и дисперсности (табл.)
Примеси первых двух групп (кроме высокомолекулярных соединений) образуют термодинамически неустойчивые гетерогенные системы, а двух других – термодинамически равновесные и обратимые гомогенные системы.
Первая группа представляет собой суспензии и эмульсии, которые кинетически неустойчивы и находятся во взвешенном состоянии благодаря гидродинамическому воздействию водного потока. Эти примеси попадают в воду вследствие эрозии слагающих ложе водоема пород и смыва с поверхности почв. К биологическим представителям примесей первой группы относятся бактерии и планктон.
Вторая группа примесей объединяет органические и минеральные коллоидные частицы, вымываемые водой из грунтов и почв, а также нерастворимые и недиссоциированные формы гуминовых веществ, вирусы и ассоциаты детергентов, которые по своим размерам относятся к коллоидной области. Агрегативная устойчивость таких примесей обусловлена наличием высокого потенциального барьера на энергетической кривой взаимодействия частиц (за счет преобладания электростатического отталкивания над молекулярным притяжением), либо образованием на межфазной поверхности стабилизирующих слоев.
Третья группа включает молекулярно растворённые соединения – газы, органические вещества естественного и искусственного происхождения. Молекулярно растворенные вещества способны за счёт водородных связей образовывать с водой непрочные соединения, существующие лишь в растворе. Большое значение эти связи имеют также при ассоциации молекул растворённого вещества; необходимым условием их возникновения является достаточная полярность валентных связей водорода в исходных веществах.
Четвёртая группа включает электролиты – вещества с ионной или сильнополярной связью, которые под влиянием полярных молекул воды распадаются на ионы. Кристаллические структуры этих веществ разрушаются главным образом в результате процесса гидратации. Для катионов наиболее характерно ион-дипольное взаимодействие при гидратации, для анионов со значительным отрицательным зарядом или малым радиусом – присоединение молекул воды за счёт образования водородных связей. Устойчивость гидратов ионов металлов возрастает с увеличением их заряда и уменьшением радиуса – гидраты ионов щелочных металлов нестойки, щелочноземельных более прочны. Гидратированные катионы можно рассматривать как аквакомплексы – комплексные соединения, содержащие в своём составе воду.
Систематизация примесей на основе их фазово-дисперсного состояния используется для выбора метода анализа примесей (см. табл.), а также выбора технологических процессов обработки воды, поскольку каждому фазово-дисперсному состоянию примесей соответствует характерная совокупность наиболее эффективных методов их удаления. Для наиболее сложного случая – очистки воды, содержащей примеси всех четырех групп – стадии технологического процесса водоочистки следует выстраивать таким образом, чтобы обеспечить последовательное удаление примесей начиная с первой и заканчивая четвертой группой .
Источник
Классификация примесей природных вод
3) Молекулярнодисперсные с размерами частиц менее 1 нм.
Грубодисперсные примеси обуславливают мутность природных вод и являются механическими примесями, состоящими из песка, глины и т.д.
Коллоиднодисперсные вещества не осаждаются даже в течение длительного времени. В природных водах в коллоиднодисперсном состоянии находятся соединения кремния, алюминия, железа, а также органические вещества, образующиеся в результате распада животных и растительных организмов.
К молекулярнодисперсным примесям относятся растворенные в воде соли, кислоты, щелочи и газы. Ионы кальция занимают в водах первое место по содержанию. Основным источником появления ионов кальция в природных водах являются известняки.
По химическому составу примеси природных вод можно разделить на два типа: 1. минеральные и 2. органические.
К минеральным примесям воды относятся растворенные в ней содержащиеся в атмосфере газы N2, O2, СО2‚ образующиеся в результате окислительных и биохимических процессов NНЗ, СН4‚ Н2S‚ а также газы, вносимые сточными водами; различные соли, кислоты, основания, в значительной степени находящиеся в диссоциированной форме, т.е. в виде образующих их катионов и анионов.
К органическим примесям природных вод относят гумусовые вещества, вымываемые из почв и торфяников, а также органические вещества различных типов, поступающие в воду совместно с сельскохозяйственными стоками и другими типами недостаточно очищенных стоков.
Высокоосновные аниониты. Зависимость обменной емкости от рН среды. Объяснить, как изменяются показатели качества воды после высокоосновного анионирования. Почему высокоосновные аниониты ставят в схемах водоочистки в ее последних ступенях?
Иониты представляют собой нерастворимые в воде вещества, которые благодаря наличию в них специальных функциональных групп способны к реакциям ионного обмена.
Высокое значение Рн в зоне обмена на анионите способствует диссоциации слабых кислот Н2СО3 и Н2SiO3 и переводу их в ионизированное состояние, поэтому они также могут участвовать в реакциях анионного обмена, но лишь при использовании сильноосновных анионитов:
С учётом значений обменных емкостей слабоосновных и сильноосновных анионитов (
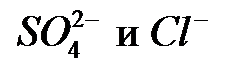
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник
Классификация природных вод и их примесей
Природные воды классифицируют по ряду признаков, простейший из них – солесодержание воды:
· пресная вода – солесодержание до 1 г/кг;
· солоноватая – солесодержание 1-10 г/кг;
· соленая – солесодержание более 10 г/кг.
Большое распространение получила предложенная О.А. Алекиным система, по которой воды различаются по преобладающему в них аниону:
— гидрокарбонатный класс с преобладающим анионом или суммой анионов и (С);
По преобладающему катиону классы делятся на три группы:
Примеси природных вод по степени дисперсности (крупности) подразделяются на:
истинно-растворенные примеси находятся в воде в виде ионов, отдельных молекул, комплексов или состоят из нескольких молекул. Размер этих частиц менее мм. В истинно-растворённом состоянии в воде находятся газы (O2, CO2, H2S, N2), а также катионы и анионы поступающих в воду солей Ca 2+ , Mg 2+ , , , , , , , ;
коллоидно-дисперсные примеси имеют размеры частиц порядка 10 -6 -10 -4 мм. Коллоидные примеси представляют собой агломераты из большого числа молекул (их может быть несколько тысяч) с наличием поверхности раздела между твердой фазой и водой. Из-за малых размеров коллоидные частицы не теряют способности к диффузии и обладают значительной удельной поверхностью. Эти частицы не выделяются из воды под действием силы тяжести, не задерживаются обычными фильтрующими материалами (песком, фильтровальной бумагой) и различимы в рассеянном свете. Коллоидные примеси могут быть как органического, так и минерального происхождения; к первым относятся гуминовые вещества, вымываемые из почвы, ко вторым − кремниевые кислоты, соединения железа;
грубодисперсные примеси (так называемые взвешенные вещества) имеют размер частиц более 10 -4 мм. Это растительные остатки, частицы песка, глины и т.д. грубодисперсные примеси имеют столь большую массу, что практически не способны к диффузии. С течением времени устанавливается определенной седиментационное равновесие, и примеси либо выпадают в осадок, либо всплывают на поверхность (при плотности частиц меньше плотности воды).
Содержание грубодисперсных примесей в природных водах различно в разное время года: для равнинных рек максимальное содержание наблюда-ется в период паводка (таяния снегов), для горных рек – в паводок и в перио-ды ливней в горах. Длительно оставаясь во взвешенном состоянии, грубодисперсные примеси обуславливают мутность воды. Чем больше размер частиц грубодисперсных примесей, тем быстрее устанавливается седиментационное равновесие и тем легче выделяются они из воды при отстаивании или фильтровании. Так, скорость отстаивания частиц песка и ила размерами 100 и 200 мкм составляет в неподвижной воде при 10°С соответственно около 7 и 0,4 мм/с.
По химическому составу примеси природных вод можно разделить на два типа: минеральные и органические.
К минеральным примесям воды относятся растворенные в ней содержащиеся в атмосфере газы N2, O2, CO2, образующиеся в результате окислительных и биохимических процессов NH3, CН4, H2S, а также газы, вносимые сточными водами, различные соли, кислоты, основания, в значительной степени находящиеся в диссоциированной форме, т.е. в виде образующих их катионов и анионов.
К органическим примесям природных вод относят гумусовые вещества, вымываемые из почв и торфяников, а также органические вещества различных типов, поступающие в воду совместно с сельскохозяйственными стоками и другими типами недостаточно очищенных стоков.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник