Тема 4: Классификация природных вод
Существуют несколько способов классификации природных вод, в основу которых положены те или иные характеристики химического состава воды.
Классификация вод по степени жесткости (табл.1). Жесткость воды – свойство, обусловленное содержанием в воде катионов двухвалентных металлов, прежде всего кальция и магния. Общая жесткость воды характеризуется содержанием в ней (мэкв/л) катионов жесткости. Величина общей жесткости может быть рассчитана по формуле
Ж (мэкв/л) = [Ca 2+ ]/20,04 + [Mg 2+ ]/12,16.
В общей жесткости воды выделяют карбонатную и некарбонатную жесткость. Карбонатная жесткость жесткость воды представляет собой ту часть общей жесткости, которая эквивалентна содержанию в воде карбонат- и гидрокарбонат-ионов. Также различают жесткость временную (устраняемую кипячением) и постоянную (неустраняемую кипячением). Временная жесткость соответствует содержанию в воде гидрокарбонатов кальция и магния. При кипячении воды происходит удаление катионов этих металлов в составе образующихся малорастворимых карбонатов:
Постоянная жесткость воды равна разности между общей и временной жесткостью, ее можно устранить только химическими реагентами.
В качестве единицы измерения жесткости воды используется моль (жесткости) на кубический метр, численно равный 1 мг-экв/л.
Классификация природных вод по величине общей жесткости
Классификации по величине общей минерализации воды. Эта классификация (табл. 2) является одной из наиболее распространенных. Величина общей минерализации воды (М) определяется по массе сухого остатка предварительно отфильтрованной и выпаренной пробы воды после высушивания до постоянной массы при температуре 105 °С.
Классификация природных вод по величине общей минерализации
С повышенной минерализацией
Классификация вод по химическому составу. В подавляющем большинстве случаев солевой состав природных вод определяется катионами Са 2+ , Мg 2+ , Nа + , К + и анионами НСO3 — , Сl — , SO4 2- . Эти ионы называются главными ионами воды; они определяют химический тип воды. Остальные ионы присутствуют в значительно меньших количествах, они не определяют химический тип воды.
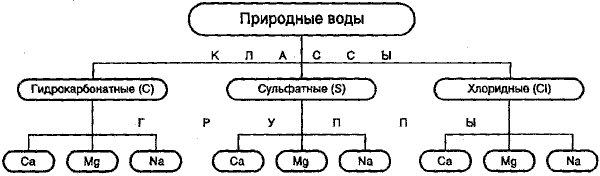
Классификация природных вод по химическому составу, предложенная О. А. Алекиным (рис. 1), считается наиболее приемлемой для вод, используемых в питьевых и хозяйственно-бытовых целях. В ее основу положены два принципа: преобладающих ионов и соотношения между ними.
Согласно этой классификации природные воды делятся по преобладающему анионуна три класса:
1) гидрокарбонатные и карбонатные (большинство маломинерализованных водрек, озер, водохранилищ и некоторые подземныеводы);
2) сульфатные воды(промежуточные между гидрокарбонатными и хлориднымиводами, генетически связаны с различными осадочнымипородами);
3) хлоридные воды(высокоминерализованныеводыокеана, морей, соленых озер, подземныеводысолончаковых районов).
Каждый класс вод подразделяется по преобладающему катиону на три группы: кальциевую, натриевую, магниевую.
Каждая группа в свою очередь подразделяетсяна четыре типаводпо соотношению содержащихся в воде ионов (в эквивалентах):
I. HCO3 — > Ca 2+ + Mg 2+ . Воды этого типа маломинерализованы и характеризуются избытком ионов HCO3 — , образуются в процессе химического выщелачиванияизверженныхпород.
II. HCO3 — < Ca 2+ + Mg 2+ < HCO3 — + SO 2- 4. К этому типу относятся подземные воды, воды рек и озёр с малой и средней минерализацией.
III. HCO3 — + SO 2- 4 < Ca 2+ + Mg 2+ или Cl - >Na + . Воды этого типа сильно минерализованы, это воды океанов и морей. К этому типу относятся водыокеанов, морей , морских лиманов.
IV. HCO3 — = 0. Характеризуется отсутствием гидрокарбонат-ионов. Воды этого типа являются кислыми и присутствуют только в хлоридном и сульфатном классах. Это болотные, шахтные, вулканические воды иливодысильно загрязненные промышленными стоками.
Рис. 1. Схема классификации природных вод по О.А. Алекину
Класс природных вод обозначается символом соответствующего аниона:
С — НСО3 — , S — SO4 2- , Сl — Сl — ;
группа: символом катиона: К + , Na + , Са 2+ , Мg 2+ ;
Формула водызаписывается следующим образом. К символу класса добавляется нижний индекс — значение минерализации (с точностью до 0,1 г/л ), к символу группы — верхний индекс — значение общего катионного состава (с точностью до целых единиц вещества в ммоль/л).
Например: С1,2 Nа 0,5 — гидрокарбонатно-натриевая вода с общей минерализацией 1,2 г/л и преобладающей концентрацией гидрокарбонатных ионов и ионов натрия.
Воды большинства рек принадлежат к гидрокарбонатному классу. По составу катионов эта вода имеет почти исключительно преобладание кальция; гидрокарбонатные воды с преобладанием магния и натрия — крайне редкое явление. Из природных вод гидрокарбонатного класса наиболее распространены воды малой минерализации (суммарное содержание солей до 200 мг/л). Они приурочены к подзолистым почвам северных районов лесной зоны и к почвам тундр (включая зону многолетней мерзлоты), которые бедны растворенными солями и обогащают воду органическими веществами. Значительно меньше рек с гидрокарбонатными водами средней минерализации. Это реки средней полосы Европы. Еще меньшую площадь занимают реки с повышенной минерализацией, которые распространены в лесостепной и степной зонах (междуречья Днестра, Южного Буга, Днепра, некоторые притоки Дона и Урала).
Реки с водой, относящейся к сульфатному классу, сравнительно малочисленны и встречаются в засушливых степях Донбасса, Приазовья, Северного Кавказа, в полупустынях Средней Азии и Казахстана. Минерализация их обычно превышает 1000 мг/л. В составе катионов природных вод сульфатного класса, так же как и в водах гидрокарбонатного класса, преобладает кальций. Однако ряд рек сульфатного класса имеет преобладание натрия. По минерализации воды сульфатного класса значительно превосходят воды гидрокарбонатного класса. Речные сульфатные воды с малой (общее количество солей до 200 мг/л) и средней (общее количество солей с 200 до 500 мг/л) минерализацией встречаются сравнительно редко. Наиболее характерна для этих рек повышенная (общее количество солей с 500 до 1000 мг/л), а иногда и высокая (общее количество солей более 1000 мг/л) минерализация воды.
Речные воды хлоридного класса встречаются почти так же редко, как и реки, в воде которых преобладают сульфаты. Это воды преимущественно степных районов и полупустынь (полупустыни Прикаспийской низменности, Западно-Сибирской равнины и Казахстана). Преобладающими катионами природных вод хлоридного класса являются главным образом ионы натрия. Воды хлоридного класса отличаются высокой минерализацией, свыше 1000 мг/л, достигающей в отдельных случаях 19000 мг/л (р. Тургай).
Источник
Классификация вод по их химическому составу
Большое разнообразие химического состава природных вод вынуждает тем или иным образом систематизировать их. До сих пор было предложено немало классификаций природных вод по их химическому составу, но вместе с тем пока еще нет простой классификации, учитывающей все особенности условий формирования химического состава всех вод и учитывающей весь комплекс растворенных веществ.
Рассмотрим только некоторые из предложенных классификаций.
Классификация вод по величине их минерализации, т. е. суммы найденных в воде ионов. Округляя различные существующие пределы, в данной классификации можно наметить следующее деление вод по величине минерализации:
пресные — до 1,0 г/кг
солоноватые — 1-25
воды с морской соленостью — 25-50
воды соленые (с соленостью выше морской) — выше 50
Область пресных вод, установленная до 1 г/кг, основана на восприятии человеком вкуса солености при наличии ионов свыше 1 г/кг. Граница в 25 г/кг между солоноватыми водами и водами с морской соленостью установлена на том основании, что примерно при этой минерализации (24,695) температуры замерзания и максимальной плотности воды равны между собой. А эти характеристики весьма важны для гидрологии. Граница между водами с морской соленостью и солеными водами установлена потому, что в морях не наблюдается минерализации свыше 50 г/кг, более высокие ее величины характерны только для соляных озер и сильно минерализованных подземных вод. Классификация вод по их минерализации дает подразделение вод только в общих чертах и не учитывает особенностей содержания отдельных ионов и газов.
Классификация О. А. Алекина сочетает принцип деления по преобладающим анионам и катионам с делением по соотношениям между ионами. Все природные ионы делятся по преобладающему аниону (по эквивалентам) на 3 класса: гидрокарбонатных (и карбонатных) (НСО3 + СО3), сульфатных (S04) и хлоридных (Сl) вод. Каждый класс по преобладающему катиону подразделяется на 3 группы: кальциевую, магниевую и натриевую. В свою очередь каждая группа подразделяется на 3 типа вод, определяемых соотношением между ионами в мг-экв.
Первый тип характеризуется соотношением НСО3 > Са + Мg. Воды этого типа образуются при значительном участии изверженных пород, содержащих большие количества Na и К — в результате чего в воде появляются ионы Na и НСО3. Могут они образовываться в некоторых случаях и при обмене Са на Nа, содержащийся в почвах или породах (например, глауконитах, щелочных глинах). Воды первого типа чаще всего мало минерализованы, но питаемые этими водами бессточные озера накапливают НСО3 и СО3 в очень больших количествах.
Второй тип характеризуется соотношением НСО3 Na. Генетически эти воды являются смешанными и подвергнувшимися значительным изменениям из-за катионного обмена, обычно Nа из раствора на Са или Мg из почв и пород. К этому типу принадлежат воды океана, морей, лиманов, реликтовых водоемов и многих сильно минерализованных подземных вод.
Четвертый тип характеризуется соотношением НСО3 = 0 т. е. воды этого типа кислые. Поэтому в класс карбонатных вод этот тип не входит, а его воды находятся только в сульфатном и хлоридном классах, в группах Са и Мg, где нет первого типа.
Для обозначения в данной классификации существуют символы. Класс обозначается символом, выводимым из названия соответствующего аниона (С, S, Сl), а группа — своим химическим символом, который пишется в виде степени к символу класса. Принадлежность к типу обозначается римской цифрой внизу символа класса. Таким образом, в целом символы пишутся следующим образом: С Ca II (гидрокарбонатный класс, группа кальция, тип второй).
Источник
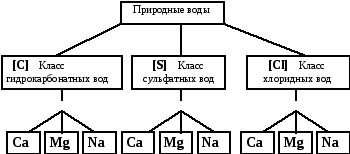
4.2. Классификация ионного состава воды о.А. Алёкина.
О.А.Алекин среди природных вод (рис. 3 ) различает три классапо преобладающему (в %-экв) аниону –гидрокарбонатный (HCO3 1- +CO3 2- ) сульфатный (SO4 2- ) и хлоридный (Cl 1- ).Каждый класс вод подразделяется натри группыпо преобладающему (в %-экв) катиону —кальциевую, магниевую инатриевую. В группах выделяют несколько типов по соотношению (в мг-экв/л) между ионами (таблица 5).
Большинство поверхностных вод суши (воды рек и озер), а также верхние горизонты подземных вод относится к водам второго типа. Воды морей, океанов, лиманов и сильно минерализованные подземные воды — к третьему типу.
При краткой записиводы по классификации О.А.Алекина класс воды обозначают символом главного химическим элемента аниона (C,S,Cl), группу — символом преобладающего катиона (Ca,Mg,Na), который указывают справа вверху от знака аниона, а тип – римской цифрой (внизу справа). Например, «C Ca II» означает: класс гидрокарбонатных вод, группа кальциевых, тип второй (жесткие пресные или солоноватые). Такой состав, как отмечено, характерен для большинства поверхностных и грунтовых вод.
Источник