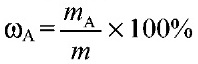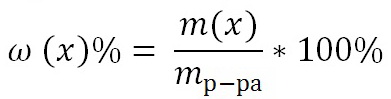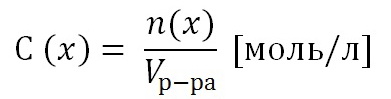- 18. Растворы: классификация растворов.
- 19. Давление насыщенного пара над раствором, эбулиоскопия, криоскопия, осмос и осмотическое давление.
- Растворы. Классификация растворов. Способы выражения концентрации растворов.
- Растворы. Физико-химические основы процесса растворения. Процесс гидратации. Растворимость. Классификация растворов: ненасыщенные, насыщенные, пересыщенные. Диаграмма состояния воды.
- «Учение о растворах»
- Классификация растворов.
- 2.2. Растворы неэлектролитов
- Давление насыщенного пара растворителя.
18. Растворы: классификация растворов.
Растворы – это гомогенные смеси двух или нескольких веществ, содержание каждого из компонентов в которых может непрерывно изменяться.
- Жидкое – растворение двух жидкостей или растворение газа или твердого тела в данной жидкости.
- Твердый раствор – однородные системы, состоящие из двух и более твердых компонентов.
- Газообразное (смесь газов) – могут смешиваться при не слишком высоких давлениях в любых соотношениях независимо от своей химической природы.
19. Давление насыщенного пара над раствором, эбулиоскопия, криоскопия, осмос и осмотическое давление.
Давление насыщенного пара над раствором равно произведению его давления над чистым растворителем на его мольную долю. (Закон Рауля). Между жидкостью и ее насыщенным паром существует динамическое равновесие жидкость↔ насыщенный пар, т.е. число молекул жидкости, испаряющихся с поверхности, равно числу конденсирующихся молекул. Этому равновесию соответствует давление насыщенного пара растворителя над чистым растворителем 





Источник
Растворы. Классификация растворов. Способы выражения концентрации растворов.
Растворы – это однородные (гомогенные) дисперсные системы, состоящие из двух или большего числа компонентов (относительные количества которых могут меняться в широких пределах) и продуктов их взаимодействия.Растворы занимают промежуточное положение между механическими смесями (растворы характеризуются непостоянством своего состава и могут быть разделены на составные части) и химическими соединениями (растворы однородны, устойчивы, образование растворов сопровождается энергетическим эффектом).
В настоящее время установлено, что при растворении молекулы растворяемого вещества связываются с молекулами растворителя, при этом образуются сольваты (если растворитель вода, то образуются гидраты). На разрушение связей между молекулами энергия затрачивается, а при образовании гидрата (сольвата) энергия выделяется; разница между этими энергиями будет наблюдаться в виде теплового эффекта растворения, которая может быть как положительной, так и отрицательной.
Способы выражения концентрации растворов.
1) Массовая доля раствора ω (х). Выражается отношением массы растворенного вещества m(х) к массе раствора.
Является величиной безразмерной или выражается в процентах:
Например, 15%-ный раствор: массовая доля ω (х) = 0,15
2) Молярная концентрация раствора С(х). Выражается отношением количества растворенного вещества n(x) к объему раствора, выраженному в литрах.
Т.к. количество вещества n(x) выражается отношением массы вещества m(x) к его молярной массе M(x), то молярную концентрацию раствора удобно выразить как
Источник
Растворы. Физико-химические основы процесса растворения. Процесс гидратации. Растворимость. Классификация растворов: ненасыщенные, насыщенные, пересыщенные. Диаграмма состояния воды.
Растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более веществ (компонентов). Растворитель — это вещество, находящееся в большом количестве, не меняющее своего агрегатного состояния при добавлении к нему другого вещества. Растворенное вещ. – находится в меньшем количестве, меняет агрегатное состояние при добавлении к растворителю. Концентрация раствора – относительное количество растворенного вещества, содержащегося в единице массы или единице объёма раствора. При растворении имеет место физико-химическое взаимодействие растворяемого вещества с молекулами растворителя, в результате которого разрушается его исходная структура и происходит образование новой структуры, свойственной раствору. При этом различают физическую и химическую стадии растворения вещества, которые протекают одновременно. На физической стадии происходит процесс измельчения растворяемого вещества до отдельных молекул или ионов и их равномерное распределение во всем объеме раствора. Осуществляется она за счет действия молекул растворителя на вещество и протекания процесса диффузии. На химической стадии растворения происходит взаимодействие частиц растворенного вещества(молекул или ионов) с молекулами растворителя и образуются химические соединения. Гидратация — присоединение молекул воды к молекулам или ионам. Гидратация является движущей силой электролитической диссоциации — источником энергии, необходимой для разделения противоположно заряженных ионов. При гидратации молекулы воды не распадаются на ионы. Гидратация обусловлена межмолекулярным взаимодействием по донорно-акцепторному механизму. Гидратация в водных растворах приводит к образованию стойких и нестойких соединений воды с растворенным веществом (гидратов); в органических растворителях образуются аналогичные гидратам сольваты (продукты присоединения растворителя к растворенным веществам). Гидратация обусловливает устойчивость ионов в растворах и затрудняет их ассоциацию (объединение простых молекул или ионов в более сложные, не вызывающее изменения химической природы вещества). Растворимость – способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях служит содержание его в насыщенном растворе. Классификация растворов Раствор называется насыщенным, если в нем находится предельное при данных условиях количество растворенного вещества. Если в растворе содержится больше растворенного вещества, то раствор называется пересыщенным, а если меньше – ненасыщенным. Диаграмма показывает те состояния воды, которые термодинамически устойчивы при определенных значениях температуры и давления. Она состоит из трёх кривых, разграничивающих все возможные температуры и давления на три области, отвечающие льду, жидкости и пару. При температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении. Такое состояние называется сверхкритической жидкостью. Диаграмма состояния воды.
Для продолжения скачивания необходимо пройти капчу:
Источник
«Учение о растворах»
Растворами называются системы, состоящие из одного или нескольких растворенных веществ и продуктов их взаимодействия, относительные количества которых могут меняться в широких пределах.
Согласно современным представлениям, растворение есть результат химического взаимодействия растворителя и растворяемого вещества, при этом между ними образуются молекулярные соединения (гидраты или сольваты). Для разрушения связей между молекулами в кристалле энергия затрачивается, а при образовании сольвата или гидрата – выделяется. Разница между этими энергиями будет наблюдаться в виде теплового эффекта при растворении.
Классификация растворов.
— истинные, размер частиц в которых d
-дисперсные (эмульсии и суспензии)
Особенности истинных растворов:
— В них отсутствует поверхность раздела между составными частями раствора.
— Они обладают одинаковым составом и свойствами по всему объему раствора.
Растворы в животных и растительных организмах являются водными, т.е. растворителем в них является вода.
Животные и растительные организмы содержат очень много воды (иногда до 90 %). Вода, как растворитель, обладает рядом уникальных свойств.
- Вода участвует в процессах набухания и осмоса, создавая в тканях организма и крови осмотическое давление.
- Обладая высокой теплоемкостью и теплопроводностью, вода поддерживает температуру тела постоянной.
- Высокая полярность молекул воды, ее высокая диэлектрическая проницаемость обуславливают участие воды в гидратации белков, углеводов, диссоциации электролитов.
2.2. Растворы неэлектролитов
Давление насыщенного пара растворителя.
Источник