1.4. Классификации состава природных вод
Классификация С.А. Щукарева основана на делении вод по шести главным ионам, присутствующим в воде в количестве, большем, чем 12,5 % -экв.
Такими могут быть только. Na, Мg, Са, Сl, SO4 и НСО3. Комбинацией трех катионов с тремя анионами можно получить 49 сочетаний, которые, по С. А. Щукареву, соответствуют 49 классам природных вод. Например, состав девятого класса воды определяется присутствием ионов Са, Мg, НСО3 и SO4 в количестве, большем, чем 12,5 %-экв каждого из них, считая сумму эквивалентов анионов за 50 %.
Классификация О. А. Алекина сочетает принцип деления по преобладающим анионам и катионам с делением по количественному соотношению между ними. Все природные воды делятся сначала по преобладающему аниону (по эквивалентам) на три класса гидрокарбонатных и карбонатных, сульфатных и хлоридных вод. Каждый класс по преобладающему катиону подразделяется далее на три группы кальциевую, магниевую и натриевую. Каждая группа в свою очередь подразделяется на четыре типа вод, определяемых соотношением между ионами в эквивалентах.
Воды типа 1 образуются или в процессе химического выщелачивания изверженных пород, или при обменных процессах Са и Mg на Na. Эти воды чаще всего маломинерализованные, исключение составляют бессточные озера, питаемые подобными водами.
Воды типа 2 — смешанные. Состав их может быть связан генетически как с осадочными породами, так и с продуктами выветривания изверженных пород. К этому типу относятся воды большинства рек, озер и подземные воды малой и умеренной минерализации.
Воды типа 3 — метаморфизированные. Они включают какую-то часть сильноминерализованных вод или вод, подвергшихся катионному обмену Na на Са или Mg. К этому типу относятся воды океана, морей, лиманов реликтовых водоемов и многие другие сильноминерализованные воды.
Для лучшей дифференциации состава воды типа 3 Е В. Посохов предложил ввести еще два подтипа
3а — с соотношением ионов Сl < Na+Мg,
3б — с соотношением ионов Сl > Nа+Мg.
Подтип 3б особенно характерен для сильно минерализованных вод лагунного происхождения. В водах этого подтипа Сl уравновешивает даже часть ионов кальция.
К типу 4, характеризуемому отсутствием НСОз — , относятся кислые воды, загрязнённые.
Классификация В.А.Александрова служит для характеристики лечебных вод. Воды по этой классификации подразделяются на 5 классов по аниону, превышающему 12,5 % экв, каждый из которых делится по преобладающим катионам:
— смешанный — включает воды, содержащие одновременно разные анионы в количестве 12,5 % экв.
Кроме этих пяти классов, различающихся по ионному составу, предусматривается одновременное разделение вод по их особым свойствам.
А. Воды с активными ионами а) железистые (>10 мг/л), б) мышьяковистые (>1 мг/л), в) йодо-бромистые (Вг> 25 мг/л, ,1>10 мг/л), г) кремнистые (>50 мг/л), д) с другими активными ионами (F, В, Li, Со и др.).
Б. Газовое воды а) углекислые (>075 г/л), 6) сероводородные (>10 мг/л), в) радоновые (>10 ед. Махе), г) другие (азотные, метановые и др ).
В. Нормальные воды а) теплые (20—37°), б) горячие (>37°).
Источник
Тема 4: Классификация природных вод
Существуют несколько способов классификации природных вод, в основу которых положены те или иные характеристики химического состава воды.
Классификация вод по степени жесткости (табл.1). Жесткость воды – свойство, обусловленное содержанием в воде катионов двухвалентных металлов, прежде всего кальция и магния. Общая жесткость воды характеризуется содержанием в ней (мэкв/л) катионов жесткости. Величина общей жесткости может быть рассчитана по формуле
Ж (мэкв/л) = [Ca 2+ ]/20,04 + [Mg 2+ ]/12,16.
В общей жесткости воды выделяют карбонатную и некарбонатную жесткость. Карбонатная жесткость жесткость воды представляет собой ту часть общей жесткости, которая эквивалентна содержанию в воде карбонат- и гидрокарбонат-ионов. Также различают жесткость временную (устраняемую кипячением) и постоянную (неустраняемую кипячением). Временная жесткость соответствует содержанию в воде гидрокарбонатов кальция и магния. При кипячении воды происходит удаление катионов этих металлов в составе образующихся малорастворимых карбонатов:
Постоянная жесткость воды равна разности между общей и временной жесткостью, ее можно устранить только химическими реагентами.
В качестве единицы измерения жесткости воды используется моль (жесткости) на кубический метр, численно равный 1 мг-экв/л.
Классификация природных вод по величине общей жесткости
Классификации по величине общей минерализации воды. Эта классификация (табл. 2) является одной из наиболее распространенных. Величина общей минерализации воды (М) определяется по массе сухого остатка предварительно отфильтрованной и выпаренной пробы воды после высушивания до постоянной массы при температуре 105 °С.
Классификация природных вод по величине общей минерализации
С повышенной минерализацией
Классификация вод по химическому составу. В подавляющем большинстве случаев солевой состав природных вод определяется катионами Са 2+ , Мg 2+ , Nа + , К + и анионами НСO3 — , Сl — , SO4 2- . Эти ионы называются главными ионами воды; они определяют химический тип воды. Остальные ионы присутствуют в значительно меньших количествах, они не определяют химический тип воды.
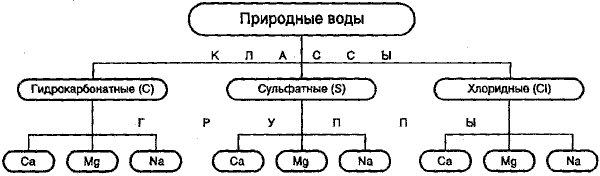
Классификация природных вод по химическому составу, предложенная О. А. Алекиным (рис. 1), считается наиболее приемлемой для вод, используемых в питьевых и хозяйственно-бытовых целях. В ее основу положены два принципа: преобладающих ионов и соотношения между ними.
Согласно этой классификации природные воды делятся по преобладающему анионуна три класса:
1) гидрокарбонатные и карбонатные (большинство маломинерализованных водрек, озер, водохранилищ и некоторые подземныеводы);
2) сульфатные воды(промежуточные между гидрокарбонатными и хлориднымиводами, генетически связаны с различными осадочнымипородами);
3) хлоридные воды(высокоминерализованныеводыокеана, морей, соленых озер, подземныеводысолончаковых районов).
Каждый класс вод подразделяется по преобладающему катиону на три группы: кальциевую, натриевую, магниевую.
Каждая группа в свою очередь подразделяетсяна четыре типаводпо соотношению содержащихся в воде ионов (в эквивалентах):
I. HCO3 — > Ca 2+ + Mg 2+ . Воды этого типа маломинерализованы и характеризуются избытком ионов HCO3 — , образуются в процессе химического выщелачиванияизверженныхпород.
II. HCO3 — < Ca 2+ + Mg 2+ < HCO3 — + SO 2- 4. К этому типу относятся подземные воды, воды рек и озёр с малой и средней минерализацией.
III. HCO3 — + SO 2- 4 < Ca 2+ + Mg 2+ или Cl - >Na + . Воды этого типа сильно минерализованы, это воды океанов и морей. К этому типу относятся водыокеанов, морей , морских лиманов.
IV. HCO3 — = 0. Характеризуется отсутствием гидрокарбонат-ионов. Воды этого типа являются кислыми и присутствуют только в хлоридном и сульфатном классах. Это болотные, шахтные, вулканические воды иливодысильно загрязненные промышленными стоками.
Рис. 1. Схема классификации природных вод по О.А. Алекину
Класс природных вод обозначается символом соответствующего аниона:
С — НСО3 — , S — SO4 2- , Сl — Сl — ;
группа: символом катиона: К + , Na + , Са 2+ , Мg 2+ ;
Формула водызаписывается следующим образом. К символу класса добавляется нижний индекс — значение минерализации (с точностью до 0,1 г/л ), к символу группы — верхний индекс — значение общего катионного состава (с точностью до целых единиц вещества в ммоль/л).
Например: С1,2 Nа 0,5 — гидрокарбонатно-натриевая вода с общей минерализацией 1,2 г/л и преобладающей концентрацией гидрокарбонатных ионов и ионов натрия.
Воды большинства рек принадлежат к гидрокарбонатному классу. По составу катионов эта вода имеет почти исключительно преобладание кальция; гидрокарбонатные воды с преобладанием магния и натрия — крайне редкое явление. Из природных вод гидрокарбонатного класса наиболее распространены воды малой минерализации (суммарное содержание солей до 200 мг/л). Они приурочены к подзолистым почвам северных районов лесной зоны и к почвам тундр (включая зону многолетней мерзлоты), которые бедны растворенными солями и обогащают воду органическими веществами. Значительно меньше рек с гидрокарбонатными водами средней минерализации. Это реки средней полосы Европы. Еще меньшую площадь занимают реки с повышенной минерализацией, которые распространены в лесостепной и степной зонах (междуречья Днестра, Южного Буга, Днепра, некоторые притоки Дона и Урала).
Реки с водой, относящейся к сульфатному классу, сравнительно малочисленны и встречаются в засушливых степях Донбасса, Приазовья, Северного Кавказа, в полупустынях Средней Азии и Казахстана. Минерализация их обычно превышает 1000 мг/л. В составе катионов природных вод сульфатного класса, так же как и в водах гидрокарбонатного класса, преобладает кальций. Однако ряд рек сульфатного класса имеет преобладание натрия. По минерализации воды сульфатного класса значительно превосходят воды гидрокарбонатного класса. Речные сульфатные воды с малой (общее количество солей до 200 мг/л) и средней (общее количество солей с 200 до 500 мг/л) минерализацией встречаются сравнительно редко. Наиболее характерна для этих рек повышенная (общее количество солей с 500 до 1000 мг/л), а иногда и высокая (общее количество солей более 1000 мг/л) минерализация воды.
Речные воды хлоридного класса встречаются почти так же редко, как и реки, в воде которых преобладают сульфаты. Это воды преимущественно степных районов и полупустынь (полупустыни Прикаспийской низменности, Западно-Сибирской равнины и Казахстана). Преобладающими катионами природных вод хлоридного класса являются главным образом ионы натрия. Воды хлоридного класса отличаются высокой минерализацией, свыше 1000 мг/л, достигающей в отдельных случаях 19000 мг/л (р. Тургай).
Источник