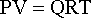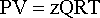Коэффициент сверхсжимаемости природных газов
Идеальные газы – это когда пренебрегают взаимодействием молекул друг с другом.
Р – абсолютное давление (Па), V – объем (м 3 ), G – масса вещества (кг), Т – температура (К), R – универсальная газовая постоянная (кДж/Ккг).
z — степень отклонения реального газа от идеального, или коэффициент сжимаемости реального газа.
Если приведенные параметры природных газов одинаковы, то они находятся в соответственных состояниях – плотность.
Приведенный параметр – это безразмерная величина, показывающая, во сколько раз параметры P,V, больше или меньше критических.
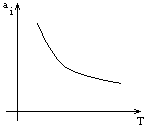
Ацентричный фактор – характеризует то, что силы, действующие между молекулами – неравноправны. z = z (Рпр,Тпр,)
i – ацентричный фактор i –того компонента в смеси.
Рпр(смеси) – среднекритический параметр смеси (псевдокритический параметр смеси). Это параметр Кейа.
Аналогично рассчитывается влияние углеводородов на коэффициент сжимаемости пласта.
Плотность стабильного конденсата
ВЯЗКОСТЬ ГАЗОВ И УГЛЕВОДОРОДНЫХ КОНДЕНСАТОВ
— средняя длина свободного пробега.
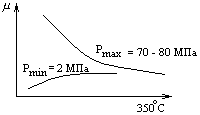
Если Р возрастает, следовательно и возрастает, а — уменьшается.
Д ля жидких УВ (газ в виде конденсата):
Изобарная удельная теплоемкость газа:
УРАВНЕНИЕ ПЕНГА – РОБИНСОНА
V – молярный объем. a(T), b – коэффициенты уравнения, определяемые критическими параметрами.
z 3 – (1 — B)z 2 +(A – 3B 2 – 2B)z – (AB – B 2 – B 3 ) = 0,
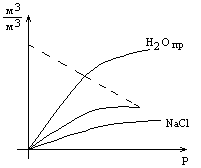
Растворимость нефти и газа в воде.
При небольших Р и Т растворимость газов подчиняется закону Генри
Кажущийся удельный объем (парциальный молярный объем), G-масса, -изменение объема.
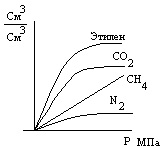
Р астворимость газов в зависимости от давления выглядит следующим образом:
С увеличением молекулярной массы газа его растворимость уменьшается. Растворимость газа зависит от свойств нефти. Растворимость газа растет при возрастании содержания в нефти парафиновых углеводородов.
Величина порядка 4 –5 10 -5 называется коэффициентом растворимости. Коэффициент растворимости зависит от Т.
С ростом Т количество растворенного газа в нефти уменьшается.
Количество растворенного или выделившегося из нефти газа зависит от условий, при которых это происходит.
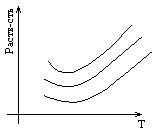
2 типа кривых разгазирования: 1) контактный тип – весь выделившийся газ
2) дифференциальный тип – газ отводится. Характерен для лабораторных условий.
Для диф. Разгазирования – количество газа больше, чем при контактном.
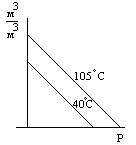
К ривая разгазирования:
Коэффициентом разгазирования принято называть количество газа, выделившееся при снижении давления на единицу.
Кроме нефти, в пласте может находиться большое количество воды.
Содержание растворенного газа в воде выражается в мольных долях.
ni – число молей; i – компонента в n растворе. i – число молей в воде.
Влияние содержания солей на растворимость выражается уравнением Сеченова:
-молярная доля газового компонента в воде. Согласно уравнению Сеченова, -константа равновесия в минерализованной воде.
Источник
25. Уравнение состояния реальных газов. Коэффициент сверхсжимаемости. (9,8)
Для определения многих физических свойств природных газов используется уравнение состояния.
Уравнением состояния называется аналитическая зависимость между параметрами, описывающими изменение состояние вещества. В качестве таких параметров используется давление, температура, объём.
Состояние газа при нормальных и стандартных условиях характеризуется уравнением состояния Менделеева-Клайперона:
где Р – абсолютное давление, Па;
Q – количество вещества, кмоль;
Т – абсолютная температура, К;
R – универсальная газовая постоянная, Па×м3/(кмоль×град).
На основе уравнения состояния газа можно рассчитать много параметров для системы нефтяного газа: плотность, мольный объем, количество молекул, число молекул, парциальные давления и др. У этого уравнения есть свои граничные условия. Оно справедливо для идеальных газов при нормальном, атмосферном давлении (1 атм) и близких к нормальному давлениях (10-12 атм).
При повышенном давлении газ сжимается. За счёт направленности связи С-Н происходит перераспределение электронной плотности, и молекулы газов начинают притягиваться друг к другу (физическое взаимодействие).
Для учёта этого взаимодействия в уравнение вводится коэффициент сверхсжимаемости z, предложенный голландским физиком Ван-дер-Ваальсом, учитывающий отклонения поведения реального газа от идеального состояния:
z – коэффициент сверхсжимаемости.
Физический смысл коэффициента сверхсжимаемости заключается в расширении граничных условий уравнения Менделеева — Клайперона для высоких давлений.
Коэффициент z зависит от давления и температуры (приведенных, критических давлений и температуры), природы газа.
Критическое давление – давление, при котором газообразный углеводород переходит в жидкое состояние.
Критическая температура – температура, при которой жидкий углеводород переходит в газообразное состояние.
Приведёнными параметрами индивидуальных компонентов называются безразмерные величины, показывающие, во сколько раз действительные параметры состояния газа отклоняются от критических.
Существуют графики, эмпирические формулы и зависимости для оценки коэффициента сверхсжимаемости от приведенных давлений и приведенных температур.
38. Влагосодержание природных газов.
Природный газ в пластовых условиях всегда насыщен парами воды, так в газоносных породах всегда содержится связанная, подошвенная или краевая вода.
Виды влажности. Влажность газа характеризуется концентрацией воды в паровой фазе системы газ – вода. Обычно она выражается массой паров воды, приходящейся на единицу массы сухого газа (массовая влажность) или числом молей паров воды, приходящейся на моль сухого газа (молярная влажность).
Абсолютная влажность W характеризуется количеством водяного пара в единице объема газовой смеси, приведенной к нормальным условиям ( T=273К, P=0,1 МПа), измеряется в г/м3 или кг/1000м3.
Относительная влажность – отношение абсолютной влажности к максимальной, соответствующей полному насыщению парами воды, при данной температуре и давлении (в %). Полное насыщение оценивается в 100 %.
Факторы, определяющие влагосодержание природных газов: давление, температура, состав газа; количество солей, растворенных в воде, контактирующей с данным газом.
Методы определения влагосодержания: экспериментально, по аналитическим уравнениям или номограммам, составленным при обработке экспериментальных или расчетных данных.
Влияние неуглеводородных компонент и свойств газа на влажность. Присутствие углекислого газа и сероводорода в газах увеличивает их влагосодержание. Наличие азота приводит к уменьшению влагосодержанияю, так как он способствует уменьшению отклонения газовой смеси от идеального газа и менее растворим в воде. С увеличение плотности (или молекулярной массы газа), за счет роста количества тяжелых углеводородов, влажность газа уменьшается из-за взаимодействия молекул тяжелых углеводородов с молекулами воды. Наличие в пластовой воде растворенных солей уменьшает влагосодержание газа, так как при растворении солей в воде снижается парциальное давление паров воды.
Влияние давления и температуры. При уменьшении температуры происходит уменьшение влагосодержания, а при падении давления его увеличение.
Источник
2.3 Коэффициент сверхсжимаемости
Идеальный газ – математическая модель газа , в которой предполагается , что по — тенциальной энергией молекул можно пренебречь по сравнению с их кинетической энер — гией , т . е . между молекулами не действуют силы притяжения или отталкивания , соударе — ния частиц между собой и со стенками сосуда абсолютно упруги , а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столк — новениями .
Created by SuhOFFF Уравнение состояния идеального газа , полученное из условия отсутствия межмо — лекулярного взаимодействия и без учёта объёма самих молекул , имеет вид :
| V ид = | NRT | (2.11) |
| p |
Здесь N – количество вещества газа ; R — универсальная газовая постоянная . Реальный газ – газ , который не описывается уравнением состояния идеального газа Менделеева — Клапейрона . Зависимости между его параметрами показывают , что молекулы реальных газов имеют конечные размеры и форму , оказывают значительное взаимное влияние и занимают определённый объём . Поэтому для их характеристики необходимо учесть параметры , связанные с молекулярным взаимодействием . Молекулы простых газов имеют сферическую форму , для них силы притяжения , которые действуют по линии , соединяющей их центры , пропорциональны расстоянию в шестой степени . Для газов с несферической формой молекул силы притяжения или оттал — кивания состоят не только из сил между центрами молекул , но и из дополнительных не — центричных сил . Для их учёта введён дополнительный параметр , называемый ацентрич — ным фактором . Приближённо ацентричный фактор компонентов может быть определён по форму — ле :
| æ p кр ö | ||||
| ln ç | i | ÷ | ||
| ç | ÷ | |||
| ç p ат ÷ | ||||
| ω i = 0,4286 | è | ø | — 1 | (2.12) |
| T кр | ||||
i T кип — 1 i Здесь T кип — табличное значение температуры кипения i- го компонента . i Коэффициент сверхсжимаемости газов – отношение объёма газа при заданных тер — мобарических условиях к объёму этого газа , определённому при идентичных термобари — ческих условиях по законам идеального газа . Другими словами , коэффициент сверхсжи — маемости характеризует отклонение объёма реального газа от объёма идеального газа . Из определения коэффициента сверхсжимаемости следует , что :
| z = | V | (2.13) |
| V ид |
Тогда :
| Created by SuhOFFF | ||
| V = | zNRT | (2.14) |
| p |
Коэффициент сверхсжимаемости газа зависит от состава газа , давления и темпера — туры . Значение коэффициента может быть определено графическими и аналитическими способами . Способ определения следует выбирать , исходя из требуемой точности . Для определения коэффициента сжимаемости природных газов , содержащих не более 2% мольных высококипящих углеводородов C 5+ , 2% ароматических углеводородов и около 5% полярных и кислых компонентов , используется графическая зависимость z от p пр и T пр ( рис . 4). Для смесей с содержанием метана более 96% при 0 < p пр < 8 коэффициент сверх -
| сжимаемости может быть определён аналитически : | |
| z = ( 0,4lg ( T пр ) + 0,73 ) p пр + 0,1p пр | (2.15) |
При более высоком содержании в газе высококипящих углеводородов C 5+ и поляр — ных компонентов коэффициент сверхсжимаемости z следует определять с учётом ацен — трического фактора .
| z = z ( 0 ) + ω см z ( 1 ) | (2.16) |
Здесь z ( 0 ) , z ( 1 ) — коэффициенты сверхсжимаемости простых веществ и веществ , со — N держащих несферические молекулы ; ω см = å ω i x i — фактор ацентричности смеси . i=1 Для более точных расчётов коэффициент сверхсжимаемости природных газов дол — жен быть определён по кубическим уравнениям состояния газов .
2.4 Плотность газа
Плотность – отношение массы газа к единице его объёма . Плотность газа зависит от его состава , давления и температуры . Плотность газовой смеси при стандартных условиях определяется с помощью мо — лекулярной массы смеси и молярного объёма :
| ρ ст | = | M см | (2.17) |
| V мол |
ст
Created by SuhOFFF Рис. 4. Зависимость коэффициента сверхсжимаемости от приведённых давления и температуры Плотность газа при заданных давлении и температуре определяется по известной плотности в стандартных условиях по формуле :
| ρ = ρ ст | pT ст | (2.18) |
| p ст zT |
Здесь z — коэффициент сверхжимаемости .
| 03.11.2010 | — 10 — |
Источник