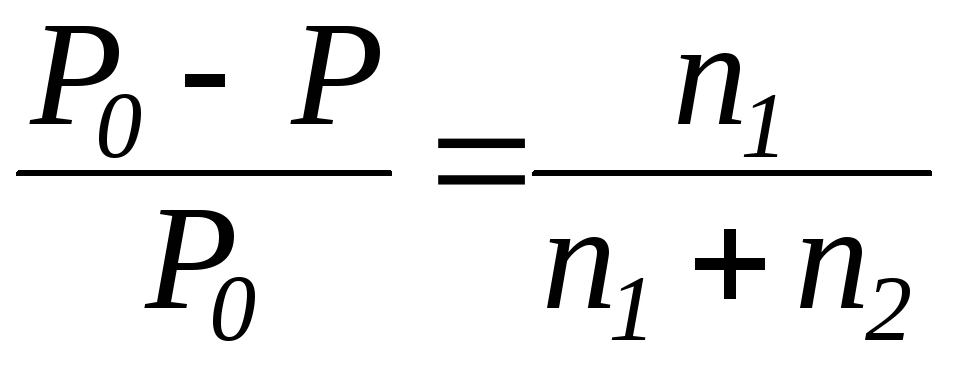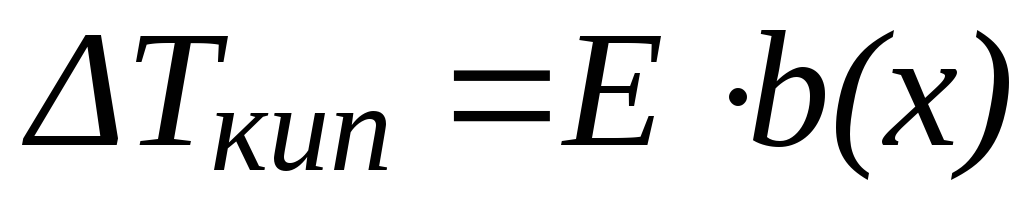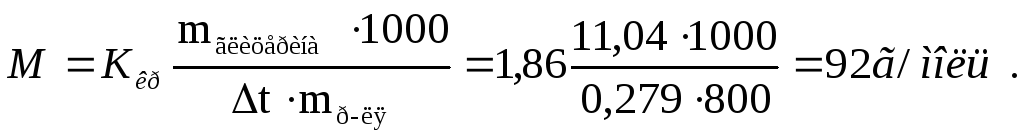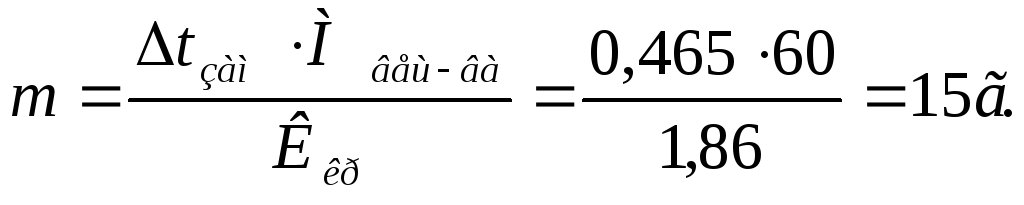Коллигативные свойства растворов
Ранее уже отмечалось, что растворы, являясь многокомпо-нентными системами, приобретают некоторые свойства, которыми не обладают отдельные компоненты раствора. Для химии большой интерес представила бы возможность определения свойств растворов по известным характеристикам индивидуальных компонентов. Однако в настоящее время такая задача не решена и общая теория растворов не создана.
В то же время термодинамическая теория растворов позволяет устанавливать взаимосвязь между отдельными характеристиками раствора. Иными словами, можно вычислять одни параметры раствора, если известны другие.
Основными независимыми переменными в теории растворов являются концентрация, температура и давление. В некоторых случаях число переменных, необходимых для расчета остальных параметров раствора, удается свести к минимуму. Так, определенные свойства разбавленного раствора нелетучего неэлектролита можно рассчитать, зная только концентрацию раствора и при этом абстрагируясь от химической природы растворенного вещества.
Свойства растворов, которые зависят только от концентрации компонентов, но не зависят от их природы, называются коллигативными.
К коллигативным свойствам растворов относят:
1) понижение давления насыщенного пара над раствором по сравнению с растворителем;
2) повышение температуры кипения и понижение температуры замерзания (кристаллизации) растворов по сравнению с раствори-телем;
Давление насыщенного пара. Закон Рауля
Пар, находящийся в динамическом равновесии со своей жидкостью называется насыщенным. Насыщенный пар характери-зуется давлением P (Па, атм), которое иногда называют упругостью пара. Давление насыщенного пара зависит от природы жидкости и от температуры. С ростом температуры давление насыщенного пара возрастает (рис. 1.).
Рис. 1. Зависимость давления насыщенного пара растворителя от температуры.
Добавление в растворитель растворенного вещества (нелетучего неэлектролита) приводит к тому, что на протяжении всего температурного интервала давление насыщенного пара растворителя над раствором (кривая 2) ниже давления насыщенного пара над чистым растворителем (кривая 1). Это связано с уменьшением количества свободных молекул растворителя на поверхности жидкости.
Относительное понижение давления пара растворителя над раствором нелетучего неэлектролита равно мольной доле раство-ренного вещества:
,
где Р – давление насыщенного пара растворителя над раствором
Р0 – давление насыщенного пара над чистым растворителем
n1 – количество растворенного вещества (моль);
n2 – количество растворителя (моль).
Температура, при которой давление пара растворителя над раствором становится равным давлению пара над твердой фазой, называется температурой кристаллизации раствора (Tкр.).
Температура, при которой давление пара растворителя над раствором становится равным атмосферному давлению, назы-вается температурой кипения раствора (Tкип.).
Из рис. 1 видно, что температура кристаллизации раствора (Tкр.) несколько ниже температуры кристаллизации чистого растворителя (T0 кр.). Разность температур кристаллизации растворителя и раствора Tкр. можно рассчитать по одному из следствий из закона Рауля:
Понижение температуры кристаллизации раствора по сравнению с растворителем прямо пропорционально моляльной концентрации раствора:
,
где К – криоскопическая постоянная растворителя (Ккг/моль);
b(х) – моляльная концентрация раствора (моль/кг).
Другое следствие из закона Рауля позволяет рассчитать повышение температуры кипения раствора по сравнению с растворителем Tкип.:
Повышение температуры кипения раствора по сравнению с растворителем прямо пропорционально моляльной концентрации раствора:
,
где Е – эбулиоскопическая постоянная растворителя (Ккг/моль).
Значения констант К и Е определяются исключительно природой растворителя.
Значения криоскопических и эбулиоскопических констант некоторых растворителей приведены в таблице 1.
Таблица 1. Физико-химические характеристики растворителей.
Температура кристал-лизации, 0 С
Эбулиоско-пическая константа, Ккг/моль.
Криоско-пическая константа, Ккг/моль.
Источник
9. Коллигативные свойства растворов
Коллигативными называют такие свойства раствора, которые зависят только от концентрации растворенного вещества и природы растворителя, но не зависят от природы растворенного вещества. К этим свойствам относятся: 1) понижение давления насыщенного пара над раствором; 2) понижение температуры замерзания; 3) повышение температуры кипения; 4) осмотическое давление.
Давление насыщенного пара при данной температуре характеризует равновесие между жидким и газообразным состоянием вещества в закрытой системе, возникающее на границе раздела фаз вследствие выравнивания скоростей эндотермического процесса испарения и экзотермического процесса конденсации. В растворе концентрация молекул растворителя в поверхностном слое меньше, чем в чистом растворителе (молекулы растворенного вещества сольватируясь (гидратируясь) занимают часть поверхности раствора), поэтому равновесие достигается при меньшем давлении насыщенного пара. Выражение Р 0 – РА = ΔРА = Р 0 А∙NB количественно выражает связь между концентрацией растворенного вещества в растворе и давлением насыщенного пара растворителя над раствором. Его называют законом Рауля: понижение давления насыщенного пара растворителя А над раствором ∆РА пропорционально мольной доле растворенного нелетучего вещества Nв.
Здесь Р 0 А и РА — давления насыщенного пара растворителя соответственно над чистым растворителем и над раствором; ∆РА – разность между давлениями насыщенного пара растворителя над раствором РА и растворителем Р 0 А.
Из выражения закона Рауля следует, что с увеличением содержания нелетучего растворенного компонента давление пара растворителя над раствором уменьшается.
Из закона Рауля возникают два следствия. Согласно одному из них температура кипения раствора выше температуры кипения растворителя. Это обусловлено тем, что давление насыщенного пара растворителя над раствором становится равным атмосферному давлению (условие кипения жидкости) при более высокой температуре, чем в случае чистого растворителя.
Повышение температуры кипения ∆Ткип. пропорционально моляльности раствора: ΔТкип = Кэ∙Сm,
где Кэ — эбуллиоскопическая постоянная. Она означает повышение температуры кипения раствора при его моляльной концентрации, равной 1.
Вспомнив определение моляльности раствора, можно записать:
Согласно второму следствию из закона Рауля температура замерзания (кристаллизации) раствора ниже температуры замерзания (кристаллизации) чистого растворителя. Раствор замерзает при более низкой температуре, чем растворитель, так как молекулы растворенного вещества при понижении температуры препятствуют формированию кристаллической решетки при затвердевании раствора.
Понижение температуры замерзания (кристаллизации) ∆Тзам. пропорционально моляльности раствора:
где Кк — криоскопическая постоянная, которая означает понижение температуры затвердевания раствора при его моляльной концентрации, равной 1.
Значения Кэ и Кк зависят от природы растворителя и не зависят от природы растворенного вещества и его концентрации.
Значения Кэ и Кк — справочные величины.
Осмотическим называется давление, под которым растворитель поступает в раствор, отделенный от растворителя полупроницаемой мембраной, которая не способна пропускать молекулы растворенного вещества, но пропускает молекулы растворителя.
Оно рассчитывается по формуле (закон Вант-Гоффа)
π = СМRT =
где π – осмотическое давление, Па, кПа, атм, мм.рт.ст.; R = 8,314 Дж/моль∙К – универсальная газовая постоянная; Т = t + 273 0 — абсолютная температура, К; mв-ва, Мв-ва – масса и молярная масса растворенного вещества, г; V – объем раствора, л.
Пример 1. Вычислить температуру кристаллизации и кипения 2%-ного водного раствора глюкозы С6Н12О6.
По закону Рауля понижение температуры кристаллизации и повышение температуры кипения раствора (Δt) по сравнению с температурами кристаллизации и кипения растворителя выражаются уравнением:
где К – криоскопическая или эбуллиоскопическая константа; для воды они соответственно равны 1,86 0 и 0,52 0 ; Сm(А) – моляльная концентрация растворенного вещества А, которая рассчитывается по формуле:
Сm(А) = . (2)
Понижение температуры кристаллизации 2%-ного раствора С6Н12О6 находим из формулы (1):
Δtзам. р-ра = = 0,21 0 .
Вода кристаллизуется при 0 о С, следовательно, температура кристаллизации раствора
tзам. р-ра = 0 – 0,21 = — 0,21 о С.
Из формулы (1) повышение температуры кипения 2 %-ного раствора С6Н12О6 равно
Δtкип. р-ра = = 0,06 о .
Вода кипит при 100 о С, следовательно, температура кипения этого раствора
tкип. р-ра = 100 + 0,06 = 100,06 о С.
Пример 2. Раствор, содержащий 1,22 г бензойной кислоты С6Н5СООН в 100 г сероуглерода, кипит при 46,529 о С. Температура кипения сероуглерода 46,3 о С. Вычислить эбуллиоскопическую константу сероуглерода.
Повышение температуры кипения раствора равно
Молярная масса бензойной кислоты равна 122 г/моль.
Из формулы (1) находим эбуллиоскопическую константу
Пример 3. Раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при – 0,28 о С. Вычислить молярную массу глицерина.
Температура кристаллизации чистой воды 0 о С, следовательно, понижение температуры кристаллизации раствора равно:
Подставляем в уравнение (1) данные, находим молярную массу глицерина:
Пример 4. Вычислить массовую долю водного раствора мочевины (NH2)2CO, зная, что температура кристаллизации этого раствора равна – 0,465 о С.
Температура кристаллизации чистой воды 0 о С, следовательно,
Зная, что молярная масса мочевины 60 г/моль, находим массу m (г), растворенного вещества, приходящуюся на 1000 г воды, из формулы:
Общая масса раствора, содержащего 15 г мочевины, составляет 1000 + 15 = 1015 г.
Массовую долю мочевины в данном растворе находим из соотношения
Источник