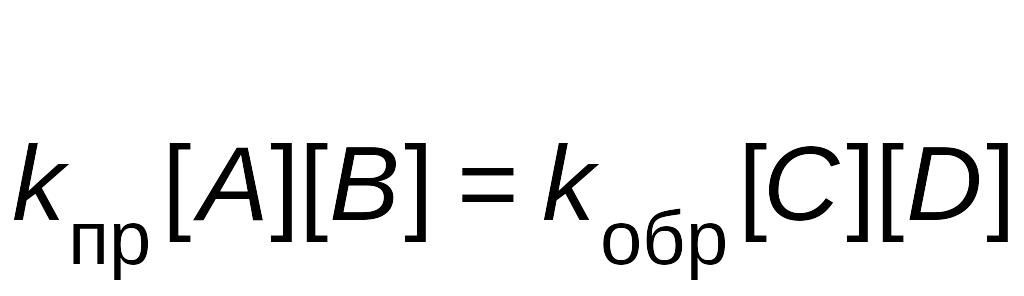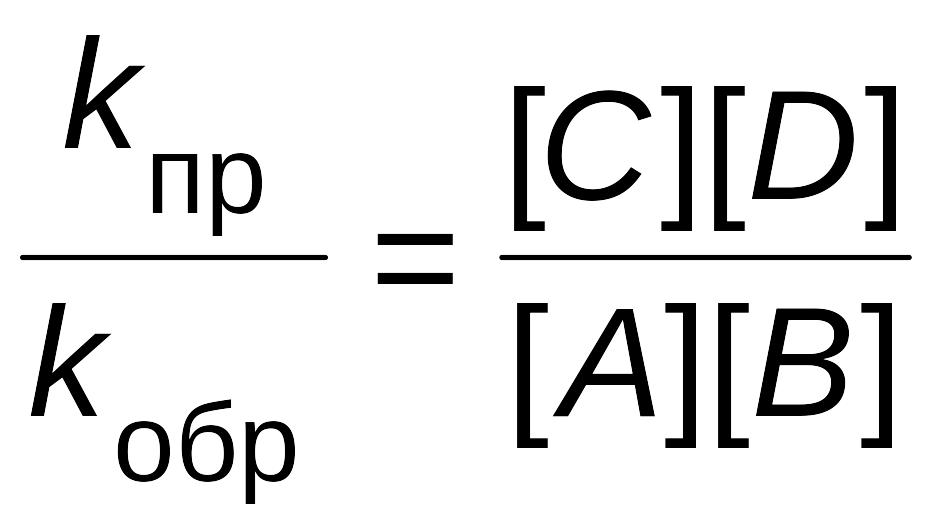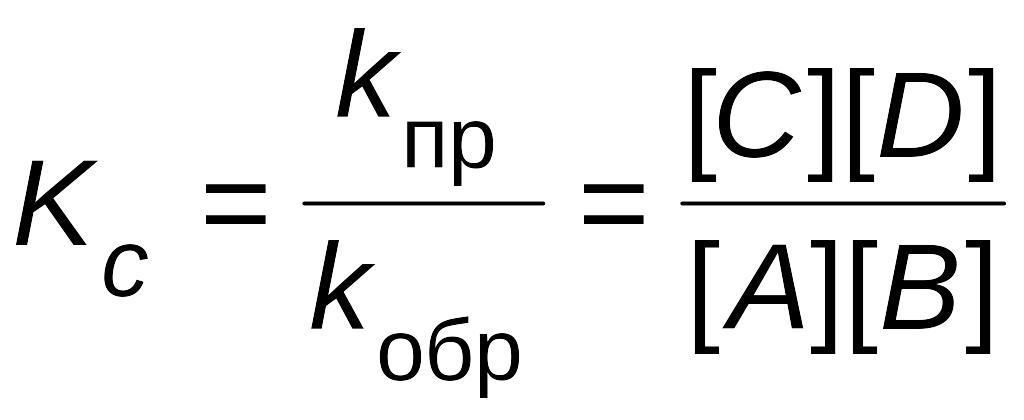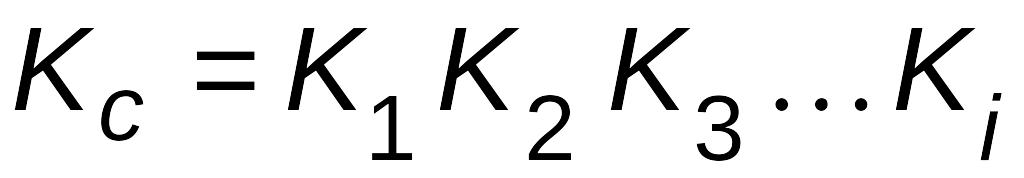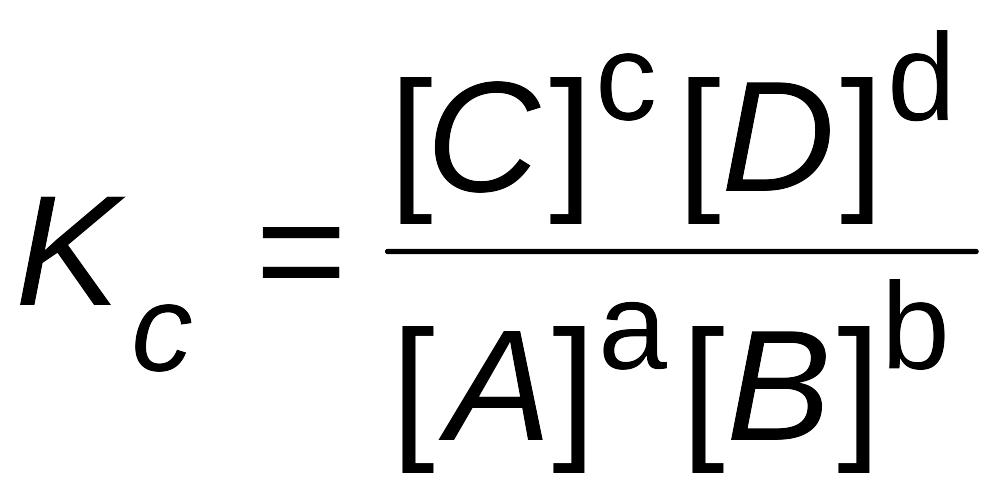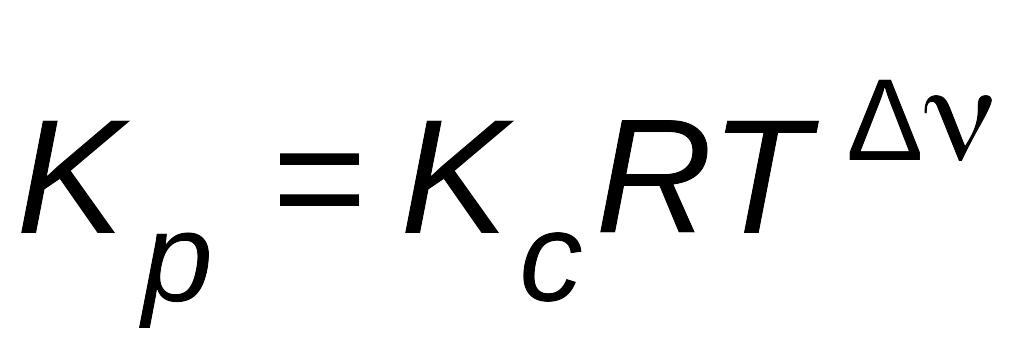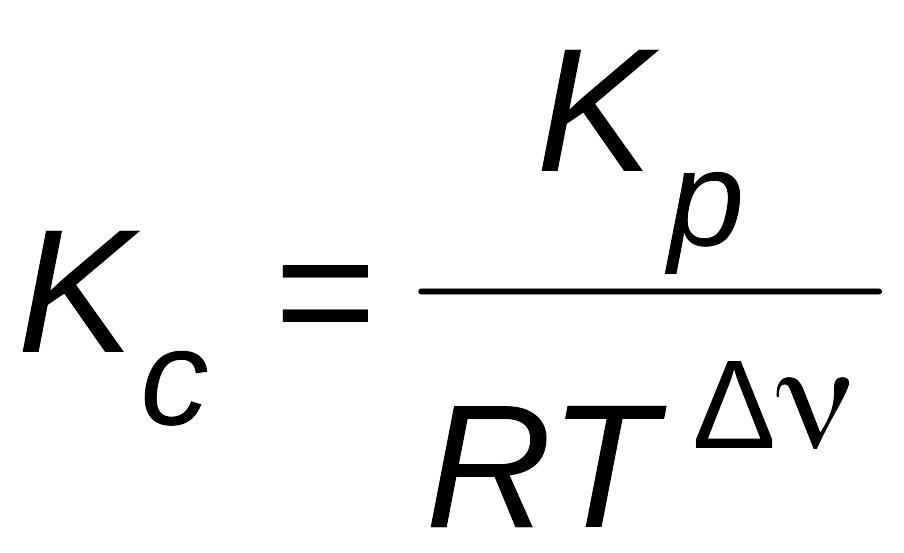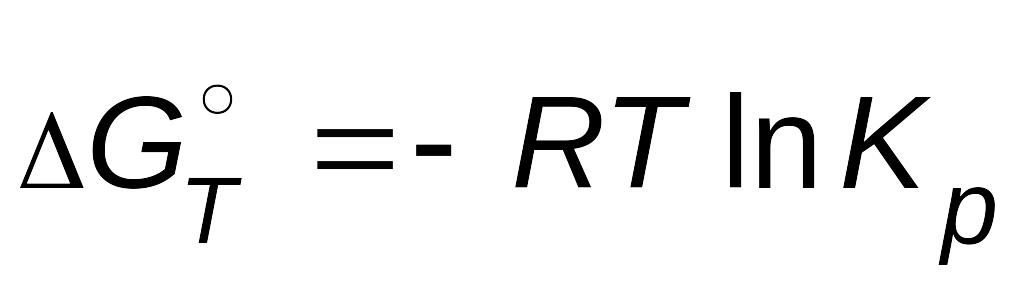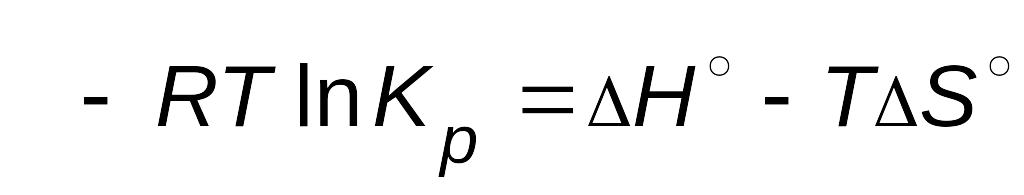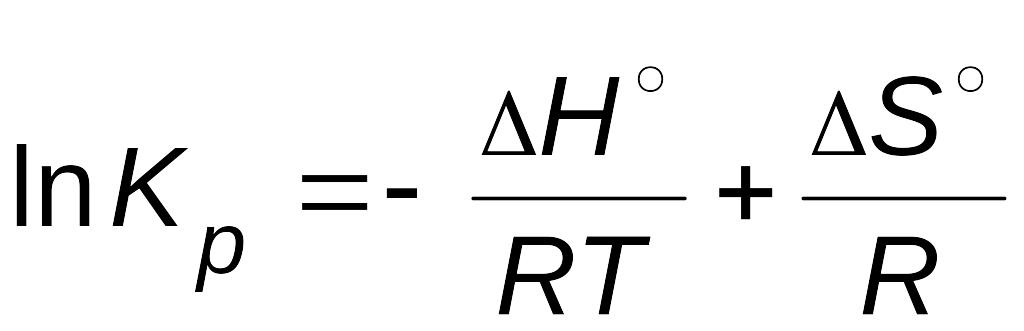Константа химического равновесия
где A и B – исходные вещества прямой реакции; C и D – продукты прямой реакции; а, в, с, и d – стехиометрические коэффициенты.
В начальный момент времени, когда концентрация веществ A и B наибольшая, скорость прямой реакции также будет наибольшей и по закону действующих масс равна
где k1 – константа скорости прямой реакции.
С течением времени концентрация веществ A и B уменьшается, а, следовательно, уменьшается и скорость прямой реакции.
В начальный момент времени концентрация веществ C и D равна нулю, а, следовательно, и скорость обратной реакции равна нулю, с течением времени концентрация веществ C и D возрастает, а, следовательно, возрастает и скорость обратной реакции и она будет равна
где k2 – константа скорости обратной реакции.
В момент достижения равновесия, концентрации принимают значение равновесных, а скорости равны между собой uпр = uобр, следовательно
Перенесем константы скорости в одну сторону, а концентрации в другую:
Отношение двух постоянных величин есть величина постоянная, и называется она константой химического равновесия:
Константа равновесия показывает во сколько раз скорость прямой реакции больше или меньше скорости обратной реакции.
Константа равновесия – это отношение произведения равновесных концентраций продуктов реакции, взятых в степени их стехиометрических коэффициентов к произведению равновесных концентраций исходных веществ, взятых в степени их стехиометрических коэффициентов.
Величина константы равновесия зависит от природы реагирующих веществ и температуры, и не зависит от концентрации в момент равновесия, поскольку их отношение – всегда величина постоянная, численно равная константе равновесия. Если гомогенная реакция идет между веществами в растворе, то константа равновесия обозначается KС, а если между газами, то KР.
где РС, РD, РА и РВ – равновесные давления участников реакции.
Перенесем объем в правую сторону
Подставим уравнение (6.9) в (6.7), для каждого реагента и упростим
где Dn – изменение числа молей газообразных участников реакции
Из уравнения (6.12) видно, что KР = КС, если не меняется количество молей газообразных участников реакции (Dn = 0) или газы в системе отсутствуют.
Необходимо отметить, что в случае гетерогенного процесса концентрацию твердой или жидкой фазы в системе не учитывают.
Например, константа равновесия для реакции вида 2А + 3В = С + 4D, при условии, что все вещества газы и имеет вид
Константа равновесия имеет большое теоретическое и практическое значение. Численное значение константы равновесия позволяет судить о практической возможности и глубине протекания химической реакции.
Если K > 1, то данная реакция протекает со значительным выходом продуктов реакции; если K > 10 4 , то реакция необратима; если K < 1, то такая реакция нетехнологична; если K < 10 -4 , то такая реакция невозможна.
Зная константу равновесия, можно определить состав реакционной смеси в момент равновесия и рассчитать константу выхода продуктов реакции. Константу равновесия можно определить, используя экспериментальные методы, анализируя количественный состав реакционной смеси в момент равновесия, или применяя теоретические расчеты. Для многих реакций при стандартных условиях константа равновесия – это табличная величина.
6.3. Факторы, влияющие на химическое равновесие. Принцип Ле-Шателье
При внешнем воздействии на систему происходит смещение химического равновесия, т. е. изменяются равновесные концентрации исходных веществ и продуктов реакции. Если в результате внешнего воздействия увеличиваются равновесные концентрации продуктов реакции, то говорят о смещении равновесия вправо (в сторону прямой реакции). Если вследствие внешнего воздействия увеличиваются равновесные концентрации исходных веществ, то говорят о смещении равновесия влево (в сторону обратной реакции).
Влияние различных факторов на смещение химического равновесия отражает принцип Ле-Шателье (1884): если на систему, находящуюся в устойчивом химическом равновесии воздействовать извне, изменяя температуру, давление или концентрацию, то химическое равновесие смещается в том направлении, при котором эффект произведенного воздействия уменьшается.
Необходимо отметить, что катализатор не смещает химическое равновесие, а только ускоряет его наступление.
Рассмотрим влияние каждого фактора на смещение химического равновесия для реакции общего вида:
Влияние изменения концентрации. Согласно принципу Ле-Шателье, увеличение концентрации одного из компонентов равновесной химической реакции приводит к сдвигу равновесия в сторону усиления той реакции, при которой происходит химическая переработка этого компонента. И наоборот, уменьшение концентрации одного из компонентов приводит к сдвигу равновесия в сторону образования этого компонента.
Таким образом, увеличение концентрации вещества А или В смещает равновесие в прямом направлении; увеличение концентрации вещества С или D смещает равновесие в обратном направлении; уменьшение концентрации А или В смещает равновесие в обратном направлении; уменьшение концентрации вещества С или D смещает равновесие в прямом направлении. (Схематично можно записать: CАили CВ ®; CСили CD ¬; ¯ CАили CВ ¬; ¯ CСили CD ®).
Влияние температуры. Общее правило, определяющее влияние температуры на равновесие, имеет следующую формулировку: повышение температуры способствует сдвигу равновесия в сторону эндотермической реакции (- Q); понижение температуры способствует сдвигу равновесия в сторону экзотермической реакции (+ Q).
Реакции, протекающие без тепловых эффектов, не смещают химического равновесия при изменении температуры. Повышение температуры в этом случае приводит лишь к более быстрому установлению равновесия, которое было бы достигнуто в данной системе и без нагревания, но за более длительное время.
Таким образом, в экзотермической реакции (+ Q) увеличение температуры приводит к сдвигу равновесия в обратном направлении и, наоборот, в эндотермической реакции (- Q) увеличение температуры приводит к сдвигу в прямом направлении, а уменьшение температуры – в обратном направлении. (Схематично можно записать: при +Q Т ¬; ¯Т ®; при -Q Т ®; ¯Т ¬).
Влияние давления. Как показывает опыт, давление оказывает заметное влияние на смещение только тех равновесных реакций, в которых участвуют газообразные вещества, и при этом изменение числа молей газообразных участников реакции (Dn) не равно нулю. При увеличении давления равновесие смещается в сторону той реакции, которая сопровождается образованием меньшего количества молей газообразных веществ, а при понижении давления – в сторону образования большего количества молей газообразных веществ.
Таким образом, если Dn = 0, то давление не влияет на смещение химического равновесия; если Dn < 0, то увеличение давления смещает равновесие в прямом направлении, уменьшение давления в сторону обратной реакции; если Dn >0, то увеличение давления смещает равновесие в обратном направлении, а уменьшение давления – в сторону прямой реакции. (Схематично можно записать: при Dn = 0 Р не влияет; при Dn 0 Р ¬, ¯Р ®). Принцип Ле-Шателье применим как к гомогенным, так и к гетерогенным системам и дает качественную характеристику сдвига равновесия.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник
4.2. Константа равновесия
,
где [A], [B], [С], [D] – равновесные концентрации веществ.
Поскольку константы скоростей не зависят от концентраций, равенство можно записать иначе:
.
Отношение констант скоростей прямой и обратной реакций
( / ) называют константой химического равновесия:
.
Рассмотрим сложную реакцию
Любую сложную химическую реакцию можно представить в виде ряда простых реакций. Для каждой из простых реакций можно записать кинетическое уравнение прямой и обратной реакций и соответствующие им выражения для констант равновесия. Константа равновесия сложной реакции равна произведению констант равновесия простых реакций, описывающих ее механизм
.
Поэтому в суммарное выражение для константы равновесия равновесные концентрации войдут в степенях их стехиометрических коэффициентов
.
В выражение константы равновесия гетерогенной реакции входят только концентрации веществ, находящихся в жидкой или газообразной фазе.
Концентрации твердых веществ не входят в выражение константы равновесия гетерогенной реакции.
Например, выражение для константы равновесия следующей реакции
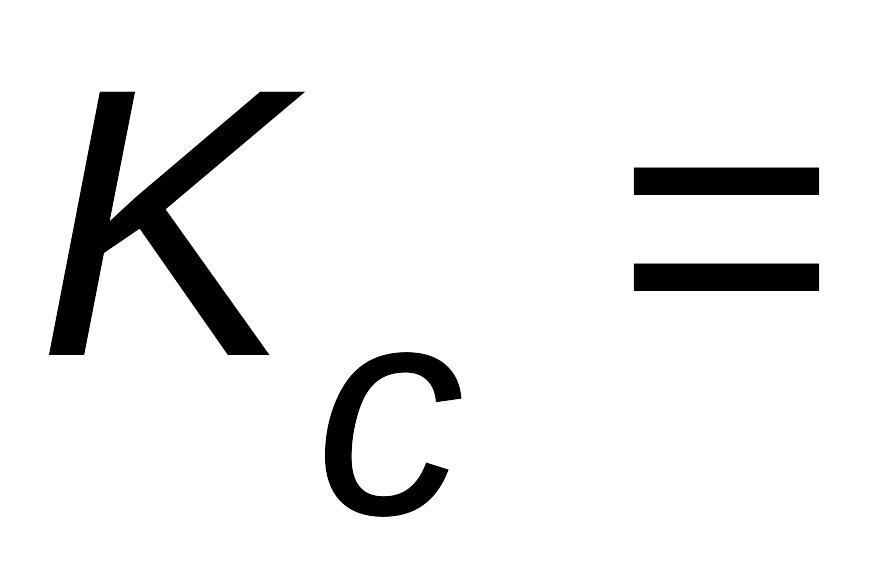
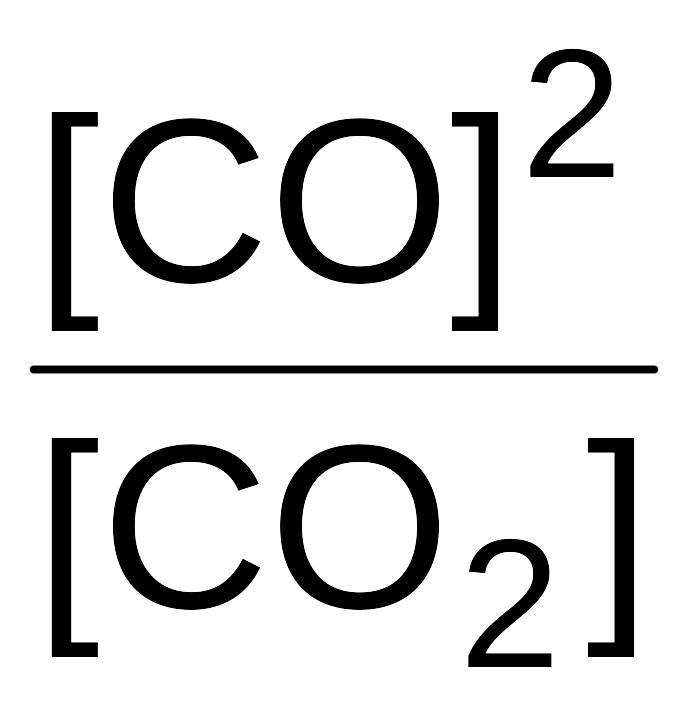
Уравнение константы равновесия показывает, что в условиях равновесия концентрации всех веществ, участвующих в реакции, связаны между собой. Численное значение константы равновесия определяет, каким должно быть соотношение концентраций всех реагирующих веществ при равновесии.
Изменение концентрации любого из этих веществ влечет за собой изменение концентраций всех остальных веществ. В итоге устанавливаются новые равновесные концентрации, но соотношение между ними вновь соответствует константе равновесия.
Величина константы равновесия зависит от природы реагирующих веществ и температуры.
Константа равновесия, выраженная через молярные концентрации реагирующих веществ 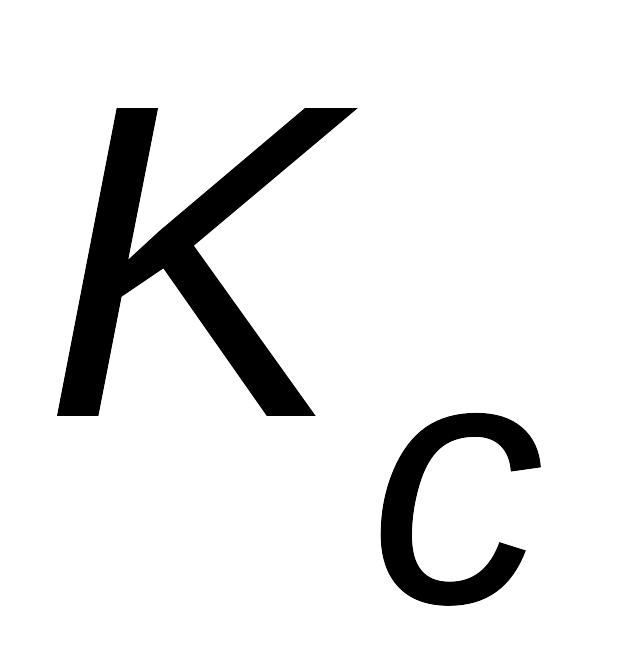
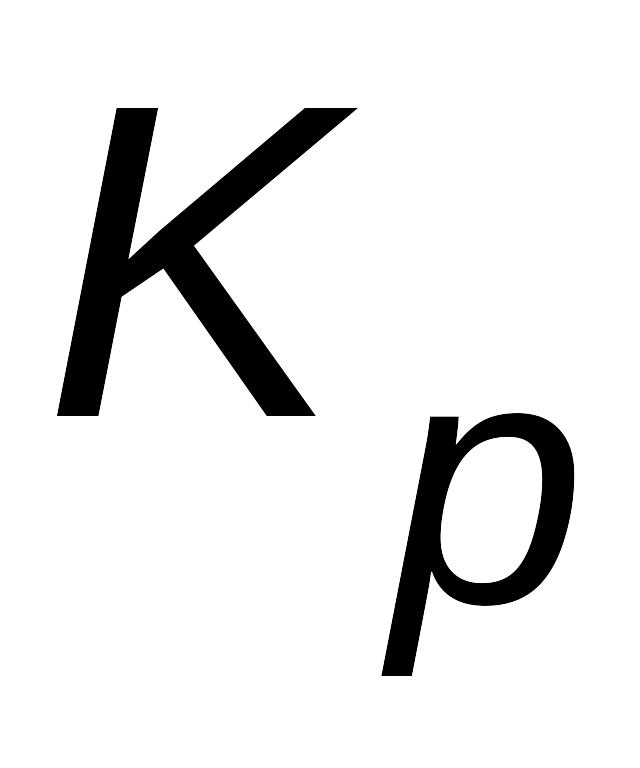
;
,
где — изменение числа газообразных молей в реакции.
Стандартное изменение энергии Гиббса равно
,
.
После приравнивания правых частей уравнений
.
Уравнение (4.3) не только устанавливает вид зависимости константы от температуры, но и показывает, что константа определяется природой реагирующих веществ.
Константа равновесия не зависит от концентраций реагентов (как и константа скорости реакции), механизма реакции, энергии активации, от присутствия катализаторов. Смена механизма, например, при введении катализатора не влияет на численное значение константы равновесия, но может изменить скорость достижения равновесного состояния.
Источник