Кремний и его соединения
Кремний и его соединения. Значение соединений кремния в живой и неживой природе. Понятие силикатной промышленности.
Кремний открыл и получил в 1823 году шведский химик Йенс Якоб Берцелиус.
Кремний — второй по распространённости элемент в земной коре после кислорода (27,6% по массе). Встречается в соединениях.
Кремний — простое вещество. Аллотропия кремния
Известен аморфный и кристаллический кремний.
Кристаллический – тёмно-серое вещество с металлическим блеском, большая твёрдость, хрупок, полупроводник; ρ = 2,33 г/см 3 , t°пл. =1415°C; t°кип. = 2680°C.
Имеет алмазоподобную структуру и образует прочные ковалентные связи. Инертен.
Аморфный — бурый порошок, гигроскопичен, алмазоподобная структура, ρ = 2 г/см 3 , более реакционноспособен.
Получение кремния
1. В промышленности – нагревание угля с песком: 2C + SiO 2 t˚ → Si + 2CO
2. В лаборатории – нагревание песка с магнием : 2Mg + SiO 2 t˚ → Si + 2MgO Опыт
Химические свойства кремния
Типичный неметалл, инертен.
как восстановитель:
1) Взаимодействие с кислородом
rак окислитель:
Si 0 + O 2 t˚ = Si +4 O 2
2) Взаимодействие фтором (без нагревания)
Si 0 + 2F 2 = SiF 4
1) Взаимодействие с металлами (образуются силициды) :
Si 0 + 2Mg t˚ = Mg 2 Si -4
3) Взаимодействие с углеродом
Si 0 + C t˚ = Si +4 C
(SiC — карборунд — твёрдый; используется для точки и шлифовки)
4) С водородом кремний не взаимодействует. Силан ( SiH 4) получают разложением силицидов металлов кислотой:
Растворяется только в смеси азотной и плавиковой кислот:
6) Со щелочами (при нагревании):
Применение кремния
Кремний широко используется в электронике как полупроводник. Добавки кремния к сплавам повышают их коррозионную стойкость. Силикаты, алюмосиликаты и кремнезем – основное сырье для производства стекла и керамики, а также для строительной промышленности.
Соединения кремния
Силан — SiH 4
Физические свойства: Бесцветный газ, ядовит, t°пл. = -185°C, t°кип. = -112°C.
Химические свойства:
Оксид кремния (IV) — (SiO 2 ) n
Кристаллическая решётка оксида кремния (IV) – атомная и имеет такое строение:
Al2O3 • 2SiO2 • 2H2O — каолинит (основная часть глины)
Физические свойства: Твёрдое, кристаллическое, тугоплавкое вещество, t°пл.= 1728°C, t°кип.= 2590°C
Химические свойства:
Кислотный оксид. При сплавлении взаимодействует с основными оксидами, щелочами, а также с карбонатами щелочных и щелочноземельных металлов:
1) Взаимодействие оксида кремния с основными оксидами:
SiO 2 + CaO t˚ = CaSiO 3
2) Взаимодействие оксида кремния с щелочами:
SiO 2 + 2NaOH t˚ = Na 2 SiO 3 + H 2 O
3) С водой оксид кремния не реагирует!
4) Взаимодействие оксида кремния с солями:
SiO 2 + CaCO 3 t˚ = CaSiO 3 + CO 2
SiO 2 + K 2 CO 3 t˚ = K 2 SiO 3 + CO 2
5) Взаимодействие оксида кремния с плавиковой кислотой:
SiO 2 + 4HF t = SiF 4 + 2H 2 O
SiO 2 + 6HF t = H 2 [SiF 6 ] (гексафторкремниевая кислота) + 2H 2 O
(реакции лежат в основе процесса травления стекла).
1. Изготовление силикатного кирпича
2. Изготовление керамических изделий
Кремниевые кислоты x • SiO2 • y H2O
x = 1, y = 1 H 2 SiO 3 — метакремниевая кислота
x = 1, y = 2 H 4 SiO 4 — ортокремниевая кислота и т.д.
Физические свойства кремниевой кислоты: H2SiO3 — очень слабая (слабее угольной), непрочная, в воде малорастворима (образует коллоидный раствор), не имеет кислого вкуса.
Получение кремниевой кислоты:
Действие сильных кислот на силикаты — Na 2 SiO 3 + 2HCl = 2NaCl + H 2 SiO 3 ↓
Химические свойства кремниевой кислоты:
При нагревании разлагается: H 2 SiO 3 t˚ = H 2 O + SiO 2
Соли кремниевой кислоты — силикаты .
1) Взаимодействие силикатов щелочных металлов с кислотами
Na 2 SiO 3 +H 2 O+CO 2 =Na 2 CO 3 +H 2 SiO 3
2) Взаимодействие силикатов щелочных металлов с солями
Na 2 SiO 3 +CaCl 2 =2NaCl+CaSiO 3 ↓
3) Силикаты, входящие в состав минералов, в природных условиях разрушаются под действием воды и оксида углерода (IV) — выветривание горных пород:
Применение соединений кремния
Источник
Кремний
Кремний — неметаллический элемент IVa группы периодической таблицы Д.И. Менделеева. Второй после кислорода элемент по распространенности в земной коре.
В чистом виде в природе практически отсутствует. Чаще всего встречается в виде кремнезема — SiO2 — песок, песчаник, кварц, глина.
Кремниевая (силиконовая) долина
Регион в штате Калифорния (США), отличающийся большой плотностью высоко технологичных компаний, связанных с производством компьютеров и микропроцессоров.
Кремний является природным полупроводником, используется как основной материал для производства микросхем. Кремний ближе, чем вы думаете: внутри гаджета, которым вы пользуетесь 😉
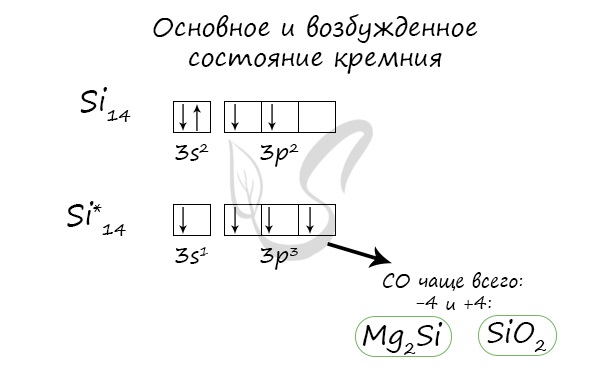
Основное и возбужденное состояние кремния
При возбуждении атома кремния электроны на s-подуровне распариваются и один из них переходит на p-подуровень.
Природные соединения
- SiO2 — кварц, кремнезем, гранит, песчаник, песок, глина
- SiO2 с примесью Fe 3+ — цитрин
- SiO2 с примесью Fe 2+ и Fe 3+ — аметист
Получение
В промышленности кремний получают путем восстановления кремнезема в электрических печах, алюминотермией.
В лабораторных условиях мелкий белый песок прокаливают с магнием:
Химические свойства
При обычных условиях без нагревания кремний реагирует только со фтором.
При нагревании кремний вступает в реакции с остальными галогенами (Cl, Br, I), углеродом, кислородом. При очень высоких температурах (1200 °C) кремний с кислородом образует оксид кремния II — несолеобразующий оксид.
В подобных реакциях кремния проявляет свои окислительные способности.
Ca + Si → Ca2Si (силицид кальция)
С целью травления (удаления поверхностного слоя материала) кремниевые изделия можно погружать в раствор щелочи.
Оксид кремния IV — SiO2
Оксид кремния IV имеет атомное строение, обладает высокой прочностью и твердостью. Плавится при температуре +1730 °C градусов.
В промышленности оксид кремния IV получают нагреванием кремния в атмосфере кислорода.
В лабораторных условиях проводят реакция силиката натрия с уксусной кислотой. Кремниевая кислота сразу же распадается на SiO2, который выпадает в осадок, и воду.
Химически SiO2 устойчив к действию кислот, однако вступает в реакцию с газообразным фтороводородом (газом) и плавиковой кислотой (жидкостью).
SiO2 является кислотным оксидом, соответствует кремниевой кислоте. Вступая в реакции с основными оксидами и щелочами, образует соли данной кислоты — силикаты.
Так как чаще всего кислотные оксиды с солями не реагируют, тем более необычной кажется реакция оксида кремния IV с карбонатами.
Кремниевая кислота
Слабая, малорастворимая в воде кислота. Ее соли носят название — силикаты.
Поскольку кремниевая кислота малорастворима, то банальной реакцией SiO2 с водой ее не получить. Эту задачу решают в две стадии через ее соли — силикаты.
Кремниевая кислота слабая, нестойкая, легко распадается на воду и оксид кремния IV.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Кремний
Источник