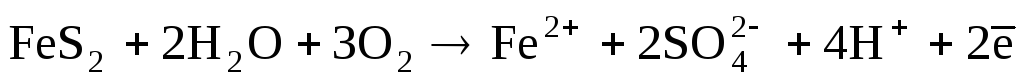Гидрогеохимия / Тема 2 начало
Любая природная вода содержит растворенные вещества; дистиллированная вода в природных условиях не встречается. Исключением может быть ювенильная вода, однако, представления о химическом и газовом составе ювенильных вод, масштабах распространения их в природе и т. д. далеко не однозначны, зачастую дискуссионны и противоречивы. Это и понятно, поскольку ювенильные воды формируются в глубоких земных недрах и процесс их образования недоступен прямому наблюдению, а на поверхность они поступают в сильно измененном виде.
Термин «ювенильные» воды впервые был предложен в 1902 году Э. Зюссом для вод, образовавшихся в глубоких недрах земли в результате дегазации магматических расплавов. При этом подчеркивалось, что это воды новые, ранее не принадлежавшие гидросфере и не участвовавшие ни в каких видах водных круговоротов Земли. Позже эта категория многократно уточнялась и модифицировалась многими исследователями [Саваренский, 1935; Семихатов, 1954; Ланге, 1969; Карцев, 1972; Самарина, 1977; Пиннекер, 1980; Ежов, 1981; Мартынова, 1983; Хаустов, 2011 и др.].
Таким образом, смысл термина ювенильная вода существенно трансформировался, в связи с чем можно сделать заключение: понятие ювенильные воды в настоящее время не имеют четкого и конкретного содержания.
В связи с неясностью в толковании категории «ювенильные воды» В.В. Хаустовым (2011) предлагается ввести понятие ювенильного водного флюида (ЮВФ).
ЮВФ представляет собой первичную, в понимании Э. Зюсса, воду, зарождение которой осуществляется в верхнемантийных, а возможно и более глубоких очагах плавления (плюмы, «горячие точки»), которая мигрирует в сторону поверхности Земли вместе с сопутствующими летучими, в первую очередь газами.
Синтез воды, входящей в состав ЮВФ, сопряжен с процессом плавления мантии при рифтогенезе или же связан с более глубокой («холодной») дегазацией Земли. Прямых диагностических признаков для воды, входящей в состав ЮВФ, на сегодня не существует, так как по сравнению с другими водами он изучен гораздо хуже. Тем не менее, современная наука, безусловно, располагает определенной информацией о целом наборе характерных признаков, касающихся ЮВФ.
Возможности идентификации ЮВФ значительно расширяются за счет изучения изотопных соотношений его газовой составляющей, наиболее информативным и достоверным здесь считается изотопное соотношение 3 Не/ 4 Не («мантийная метка» — 3 Не/ 4 Не=R~10 -5 ) [Якуцени, 1968; Мамырин, Толстихин, 1981; Kyser, Rison, 1982; Lupton, 1983; O’Nions, 1984 и др.; Поляк, 1988; Прасолов, 1990 и др.].
Что же касается минерализации и солевого состава ювенильных вод, то в гидрогеохимии трудно найти еще один вопрос, по поводу которого мнения ученых были бы столь же противоречивы. Одна группа исследователей считает их крепкими рассолами [Дерпгольц, Гавриленко, 1971; Капченко, 1966 и др.], другая — водами с очень низкой минерализацией [Мартынова, Грачев, 1980; Карцев, 1972; Ежов, 1976; Розин, 1977 и др. ], третья настаивает на их близости с водой современного океана. [Rubey, 1964; Валяшко, 1966; Виноградов, 1989; Когарко, Рябчиков, 1978 и др.]. Наиболее убедительной В.В. Хаустову(2011) представляется гипотеза М.А. Мартыновой, поскольку в момент своего зарождения ювенильные воды не могут содержать в себе растворенных веществ.
Природная вода представляет собой водный раствор, т. е. дисперсную систему. В этом растворе чистая вода является растворителем (диспергатором), а содержащиеся в ней вещества — растворенными компонентами (дисперсной фазой).
«Чистую» воду можно рассматривать как полимеризованную жидкость с формулой (Н2О)n. Степень полимеризации n зависит от температуры и давления. Так называемые кластеры (агрегированные полимолекулы), встречающиеся наряду с отдельными молекулами воды, обычно имеют при 0°С структурную формулу H180O90, а при 70°С – Н50O25 [57 Holting В. Hydrogeologie — Einfuhrung in die Allgemeine und Angewandle Hydrogeologie. Stuttgart, 1980.].
Как показывают характеристики электропроводности, «чистая» вода также диссоциирует по схеме
Часто упрощенно вместо Н3О + записывают Н + ; тогда ионное произведение воды Kв будет иметь вид: Kв = cн+ cОH—= [Н + ] [OН — ]. Величина Kв зависит от температуры и при 25°С составляет 1,0-10 -14 моль 2 /л 2 .
Водородный ион (H + ).
Таким образом, диссоциация воды, представленная уравнением
, (1)
предопределяет присутствие в природном растворе ионов водорода и гидроксил-иона.
Концентрации ионов водорода и гидроксил-иона в нейтральной среде составляют 10-7 г-моль/л; поскольку ионная масса водорода равна 1, эта величина равна 10 -7 г/л, или 10 -4 мг/л. Концентрации ионов водорода из-за их малых значений принято выражать в логарифмической форме .
Для большинства природных вод pH изменяется в пределах от 6 до 8. Воды с низкими значениями pH (иногда до 2–3) встречаются в зонах окисления сульфидных руд, обычно обогащенных серной кислотой, образующейся по реакциям типа
; (2)
. (3)
Концентрация ионов водорода в таких водах может достигать десятков миллиграммов на литр; они активно взаимодействуют с карбонатными породами, переносят на большие расстояния ионы металлов.
Природные воды, представляющие собой растворы соляной или серной кислоты, встречаются в кратерах некоторых вулканов на Камчатке и Курильских островах. Содержание ионов водорода в таких водах может достигать десятков и даже сотен миллиграммов на литр, а pH снижаться до 1,5–2 и ниже.
Гидроксил-ион (OH – ). В большинстве природных вод концентрации гидроксил-иона, определяемые значениями 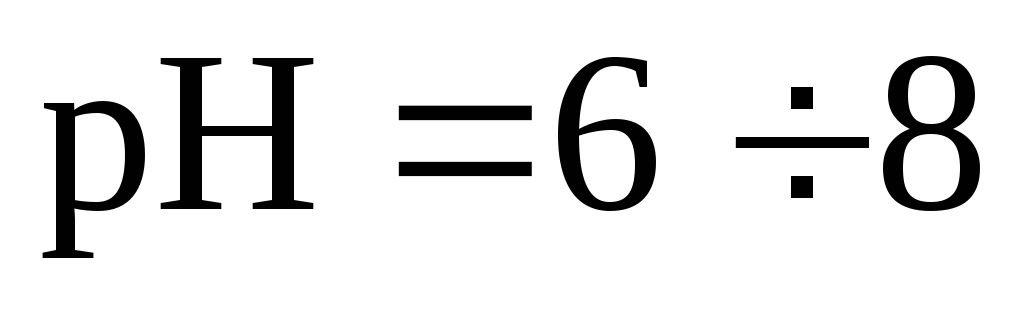
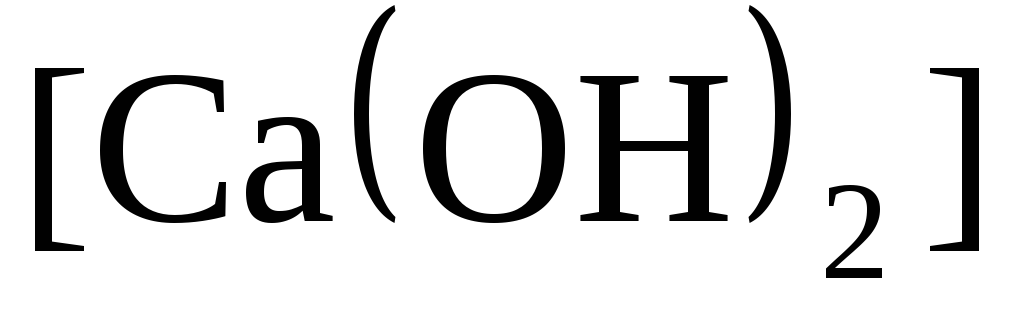
2.2. Изотопный состав природной воды
Благодаря работам Вл.Ив. Ферронского, Иг. Нест. Толстихина по изотопии воды нам известно, что в природе вода, в основном, представляет собой смесь девяти различных молекул (Н2 16 О, Н2 17 О, Н2 18 О, HD 16 О, HD 17 О, HD 18 О, D2 16 О, D2 17 О, D2 18 О), отличающихся изотопами водорода ( 1 H— протий, 2 H(D)—дейтерий и 3 Н(Т)—тритий) и кислорода ( 16 О, 17 О и 18 О).
1 H – протий – 99,98 %
2 Н (D) – дейтерий – 0,02 %
3 Н (Т) – тритий – 3 . 10 -16 %
На Земле 3-10 кг ест. трития. Период полураспада 12,26 лет
16 О; 17 О; 18 О – стабильные изотопы кислорода;
14 О; 15 О; 19 О – короткоживущие;
SMOW – Standard of Marine Ocean Water D – 0,0158 о /оо; 18 О – 0, 1985 о /оо
99,8 % молекул воды имеют массу 18( 1 H 16 О 1 H). Вода с формулами D2 16 О, D2 17 О, D2 18 О называется тяжелой (ее получают при длительном электролизе обычной воды) D2O: плотность – 1,1 г/см 3 ; tплавл – 3,81 о ; tкип – 101,4 о ; плотность макс при 11,3 о
Прямая Крейга: D = 8 18 O + 10 о /оо
Вода, содержащая сверхтяжелый изотоп водорода, — тритий (образуется в процессах ядерного распада)—называется сверхтяжелой (Т2О)
[5 Возная Н. Ф. Химия воды и микробиология. М., Высшая школа, 1979].
С участием трития, образующегося также в атмосфере под действием космического излучения, происходит примерно10 -20 частей образования 3 Н 16 О 1 Н на одну часть Н2О. Эта водная молекула играет важную роль в качестве мигранта-трассера для определения возраста «молодых» вод зоны активного водообмена.
Т2О: – 1,33 г/см 3 ; t о пл – 9 о ; t о кип 104 о ; Ест. фон 3-5 Т.Е.; Теперь: 2 Т.Е.
Источник
Тема 1.4. Свойства и применение воды. Растворы
план-конспект урока
Опорный конспект по теме » Вода . Свойства воды . Водные растворы » для самостоятельного изучения и подготовки к уроку. . Водные растворы . Вода — жизненная среда всех живых организмов. Человек живет на суше, но его организм на 65-70% состоит из воды .
Скачать:
| Вложение | Размер |
|---|---|
| | 34.06 КБ |
| | 15.37 КБ |
| | 1.02 МБ |
| | 901.91 КБ |
| | 13.1 КБ |
Предварительный просмотр:
Тема урока: «Вода. Свойства воды. Водные растворы»
Чистая вода — прозрачная жидкость, без цвета, вкуса и запаха, плотность 1 кг/л, температура кипения 100 °С при 1 атм, температура плавления 0°С. У воды высокая удельная теплоемкость — 4,12 кДж/кг К), поэтому она долго нагревается и медленно остывает. У воды большая теплота испарения. На испарение 1 г воды требуется 2,25 кДж теплоты.
Атомы Н и О в молекуле воды соединены полярными ковалентными связями. На атоме водорода в молекуле Н 2 О имеется небольшой положительный заряд δ+, а на атоме кислорода — небольшой отрицательный δ-. Поскольку молекула воды имеет уголковое строение, она представляет собой двухполюсную частицу — диполь : . Между молекулами воды существует межмолекулярная водородная связь: Н 2 O ··· Н 2 O .
Вода реагирует со многими металлами по типу реакций замещения.
С наиболее активными металлами — от Li по Аl в ряду активности металлов при комнатной температуре протекают реакции замещения одного атома Н в молекуле Н 2 O . С магнием реакция идет при нагревании, с алюминием — после снятия защитной оксидной пленки. В реакции образуются гидроксиды металлов — соединения, содержащие гидроксогруппу ОН, и водород:
2Li + 2Н 2 O = 2LiOH + Н 2 ↑,
Са + 2Н 2 O = Са(ОН) 2 + Н 2 ↑.
Менее активные металлы — Zn, Mo, W, Fe — взаимодействуют с водой при высокой температуре (400-600 °С). В этих реакциях образуются оксиды металлов и водород:
Zn + Н 2 O = ZnO + Н 2 ↑,
3Fe + 4Н 2 O = Fe 3 O 4 + 4Н 2 ↑
Вода реагирует с оксидами активных металлов (реакция гидратации). При этом получаются растворимые в воде гидроксиды металлов — щелочи :
Na 2 O + Н 2 O = 2NaOH,
СаО + Н 2 O = Са(ОН) 2 .
Вода соединяется с оксидами многих неметаллов. При этом получаются растворимые в воде гидроксиды неметаллов — кислоты :
СO 2 + Н 2 O = Н 2 СO 3 ,
SO 3 + Н 2 O = H 2 SO 4 .
Гидролиз — это обратимая реакция обмена, например соли с водой. При этом происходит расщепление молекул воды на Н и ОН, которые входят в состав двух новых веществ:
К 2 СO 3 + Н 2 O = КНСО 3 + КОН,
РСl 3 + ЗН 2 O = Н 3 РО 3 + ЗНСl.
Вода в жизнедеятельности человека. Водные растворы
Вода — жизненная среда всех живых организмов. Человек живет на суше, но его организм на 65-70% состоит из воды. Все процессы в живой клетке осуществляются в водной среде. В сутки человеку необходимо 2 л питьевой воды. Кроме того, вода нужна, чтобы варить пищу, стирать белье, умываться. Большие количества пресной воды расходуются в промышленности и сельском хозяйстве (растворитель). Отметим, что соленая вода морей и океанов для этих целей непригодна. Доля пресной воды в общих запасах воды на Земле составляет менее 3% от всех водных ресурсов.
Вода — химический реагент. Соединяясь с оксидами активных металлов, вода образует щелочи, а в реакциях с оксидами неметаллов дает кислоты — два больших и важных в деятельности человека класса веществ. Один из способов синтеза этилового спирта (этанола) C 2 H 5 OH — реакция этилена С 2 Н 4 с водой:
С 2 Н 4 + Н 2 O = С 2 Н 5 ОН.
Жесткость воды — это свойства воды, обусловленные содержанием в ней ионов Са 2+ , Mg 2+ , Fe 2+ . Если концентрация этих ионов велика, то воду называют жесткой, если мала — мягкой. При стирке с мылом в жесткой воде образуются осадки, часть мыла уходит в осадок и ухудшается качество ткани. Такая вода непригодна для охлаждения в радиаторах автомобилей, в паровых котлах и стиральных машинах. При нагревании жесткой воды образуется накипь, которая забивает трубы и ускоряет изнашивание механизмов. Различают временную и постоянную жесткость воды.
Временная или карбонатная жесткость вызвана присутствием растворенных гидрокарбонатов кальция Са(НСО 3 ) 2 , магния Mg(HCO 3 ) 2 и железа Fe(HCO 3 ) 2 . При кипячении воды гидрокарбонаты разлагаются с образованием осадка карбоната, и жесткость воды снижается:
Са(НСO 3 ) 2 = СаСО 3 ↓ + СO 2 ↓ + Н 2 O,
Fe(HCO 3 ) 2 = FeCO 3 ↓ + CO 2 ↓ + Н 2 O.
Другой способ устранения временной жесткости — действие известкового молока или соды:
Постоянная жесткость воды обусловлена присутствием в ней хлоридов, сульфатов и других растворимых солей кальция, магния и железа. Ее устраняют действием соды:
СаСl 2 + Na 2 CO 3 = СаСO 3 ↓ + 2NaCl.
Водный раствор — разновидность раствора, в котором растворителем служит вода. Будучи превосходным растворителем, именно вода используется для приготовления большинства растворов в химии.
Вещества, которые плохо растворяются в воде, называют гидрофобными (‘боящимися воды’), а хорошо в ней растворяющиеся — гидрофильными (‘любящими воду’). Примером типичного гидрофильного соединения может служить хлорид натрия (поваренная соль).
Если вещество образует водный раствор, который хорошо проводит электрический ток, то он называется сильным электролитом; в противном случае — слабым.
Источник