- Методы диагностики кокцидиоза птиц
- 1. МЕТОДЫ ОТБОРА ПРОБ
- 2. МЕТОДЫ ИССЛЕДОВАНИЙ
- Кокцидиоз птиц
- Этиология.
- Причины заражения кокцидиозом.
- Стадии и симптомы кокцидиоза у кур.
- Первая стадия
- Вторая стадия
- Третья стадия
- Четвёртая стадия
- Диагностика кокцидиоза у птицы.
- Методы профилактики.
- Главные меры успешной профилактики:
Методы диагностики кокцидиоза птиц
ГОСТ 25383-82
(СТ СЭВ 2547-80)
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
Методы лабораторной диагностики кокцидиоза
Domestic animals. Methods of laboratory diagnostics of coccidiosis
Срок действия с 01.01.83
до 01.01.88*
_________________________________
* Ограничение срока действия снято
постановлением Госстандарта России от 30.06.92 N 620
(ИУС N 9, 1992 год). — Примечание изготовителя базы данных.
РАЗРАБОТАН Министерством сельского хозяйства СССР
Б.А.Тимофеев, И.А.Коблова, Л.М.Шалова
ВНЕСЕН Министерством сельского хозяйства СССР
УТВЕРЖДЕН и ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета СССР по стандартам от 11 августа 1982 г. N 3154
ВНЕСЕНО Изменение N 1, утвержденное и введенное в действие с 01.01.88 Постановлением Госстандарта СССР от 27.05.87 N 1714
Изменение N 1 внесено изготовителем базы данных по тексту ИУС N 8, 1987 год
Настоящий стандарт распространяется на все виды сельскохозяйственных животных и птиц и устанавливает методы лабораторной диагностики кокцидиоза.
Стандарт полностью соответствует СТ СЭВ 2547-80.
1. МЕТОДЫ ОТБОРА ПРОБ
1.1. Для проведения исследований отбирают пробы кала животных, пробы патологического материала, а также пробы подстилки.
1.2. Пробы кала берут от живых и павших животных.
1.2.1. От живых животных пробы кала берут у животных из одного стада, станка или же стаи с учетом числа животных в группе.
Если число животных в группе менее 100, кал берут не менее чем от 20 животных; в группе с числом животных от 101 до 500 — от 10%; с числом животных от 501 до 1000 — от 5% и с числом животных свыше 1000 — от 2% животных.
1.2.2. Кал берут из прямой кишки животного. От каждой головы крупного рогатого скота берут 50 г кала, овец, коз и свиней — 20 г, домашней птицы и кроликов — 10 г.
Отобранные пробы смешивают, получая объединенную пробу.
В случае проведения исследований кала от каждого животного смешивание проб не производят.
Допускается отбирать пробы кала с пола станков, выгулов и т.п.
1.2.3. От павших животных кал берут из конца ободочной кишки или из прямой кишки в количествах, указанных в п.1.2.2.
1.2.4. Отобранные пробы кала упаковывают в полиэтиленовый пакет или помещают в хорошо закрывающийся сосуд.
До проведения исследований пробы хранят при температуре 2-4 °С или консервируют, добавляя 2,5%-ный раствор бихромата калия.
1.3. Пробы патологического материала отбирают при вскрытии павших животных.
Пробы берут из патологоанатомически измененных частей кишки, у кроликов — также из желчного пузыря и паренхимы печени, у гусей — из почек. Если пробы нельзя исследовать сразу, кишку разрезают в продольном направлении и помещают в 2,5%-ный раствор бихромата калия. Из печени кроликов вырезают беловатые очаги и консервируют их тем же способом. Пробы для гистологического исследования хранят в 10%-ном растворе формальдегида.
1.4. Пробы подстилки в зависимости от размера помещения отбирают не менее чем из десяти разных мест в бумажный или полиэтиленовый пакет.
1.5. Ко всем отобранным пробам прилагают сопроводительный документ с указанием:
заболеваемости или смертности;
способа проведенной санитарной обработки;
даты взятия материала для исследования.
2. МЕТОДЫ ИССЛЕДОВАНИЙ
2.1. Методы определения наличия ооцист в кале
Сущность метода заключается в определении с помощью микроскопа наличия ооцист кокцидий, всплывающих на поверхность раствора с исследуемым материалом.
2.1.1. Аппаратура, материалы и реактивы
2.1.1.1. Для проведения исследования применяют:
микроскоп с окулярным микрометром марки МБИ-3 по ГОСТ 8284-78;
весы лабораторные общего назначения по ГОСТ 24104-80* с наибольшим пределом взвешивания 200 г;
* На территории Российской Федерации действует ГОСТ Р 53228-2008, здесь и далее по тексту. — Примечание изготовителя базы данных.
центрифугу с частотой вращения 5000 мин;
стаканы стеклянные вместимостью 150-200 см и 1000 см по ГОСТ 25336-82;
чашки стеклянные лабораторные по ГОСТ 25336-82;
стекла предметные по ГОСТ 9284-75 и покровные по ГОСТ 6672-75;
пипетки градуированные исполнений 1, 2, 4, 5, 6, 2-го класса точности вместимостью 50 см по ГОСТ 20292-74*;
* На территории Российской Федерации действуют ГОСТ 29169-91, ГОСТ 29227-91-ГОСТ 29229-91, ГОСТ 29251-91-ГОСТ 29253-91. — Примечание изготовителя базы данных.
посуду лабораторную фарфоровую;
* На территории Российской Федерации действует ГОСТ 9412-93. — Примечание изготовителя базы данных.
вату гигроскопическую медицинскую по ГОСТ 5556-81;
(Измененная редакция, Изм. N 1).
2.1.2. Подготовка к исследованию
2.1.2.1. Приготовление флотационного раствора
К 1 дм горячей воды добавляют 400 г хлористого натрия, тщательно размешивают, выдерживают 30 мин и фильтруют через вату или складчатый фильтр в чистую склянку. Плотность флотационного раствора должна составлять 1,3 г/см.
(Измененная редакция, Изм. N 1).
2.1.3. Проведение исследования
2.1.3.1. Из пробы выделяют навеску кала массой 3-5 г, помещают навеску в ступку, заливают 15-20 см воды, размешивают до жидкой консистенции и процеживают через марлю в центрифужные пробирки.
Пробирки центрифугируют в течение 5 мин с частотой вращения 5000 мин. Жидкую часть сливают, затем добавляют 10 см флотационного раствора, тщательно перемешивают палочкой и повторно центрифугируют. При помощи петли из каждой пробирки берут по три капли раствора, наносят на предметное стекло и накрывают покровным стеклом. Определяют наличие ооцист под микроскопом. После проведения одного исследования петлю обжигают.
(Измененная редакция, Изм. N 1).
2.2. Метод определения количества ооцист в кале
2.2.1. Аппаратура, материалы и реактивы
2.2.1.1. Для проведения исследования применяют аппаратуру, материалы и реактивы, указанные в п.2.1.1, и дополнительно счетную камеру Горяева.
(Измененная редакция, Изм. N 1).
2.2.2. Проведение исследования
2.2.2.1. Взвешивают 5 г кала, взятого из отобранной пробы, и тщательно размешивают в ступке с 45 см воды. Полученную суспензию фильтруют через один слой марли, осадок отбрасывают. 10 см фильтрата помещают в центрифужную пробирку и центрифугируют в течение 5 мин с частотой вращения 5000 мин. Жидкую часть сливают, к осадку добавляют 10 см флотационного раствора, тщательно перемешивают и еще раз центрифугируют в течение 5 мин с частотой вращения 5000 мин. Из пробирки снимают при помощи петли поверхностный слой жидкости и в счетной камере Горяева подсчитывают количество ооцист во всех 225 квадратах. Для определения количества ооцист в 1 г кала, подсчитанное в камере Горяева, число ооцист умножают на 1111.
(Измененная редакция, Изм. N 1).
2.2.3. Обработка результатов
2.2.3.1. У домашней птицы наличие 50000 ооцист на 1 г кала не влияет на зоотехнические показатели цыплят, обнаружение более 100000 оосцист на 1 г кала свидетельствует о заражении средней степени, обнаружение ооцист в количестве более 300000 на 1 г кала — о высокой степени заражения и малой эффективности применяемого препарата.
У крупного рогатого скота и овец наличие до 1000 ооцист в 1 г кала свидетельствует о низкой степени заражения, до 5000 — о средней степени заражения, более 5000 — о высокой степени заражения.
Источник
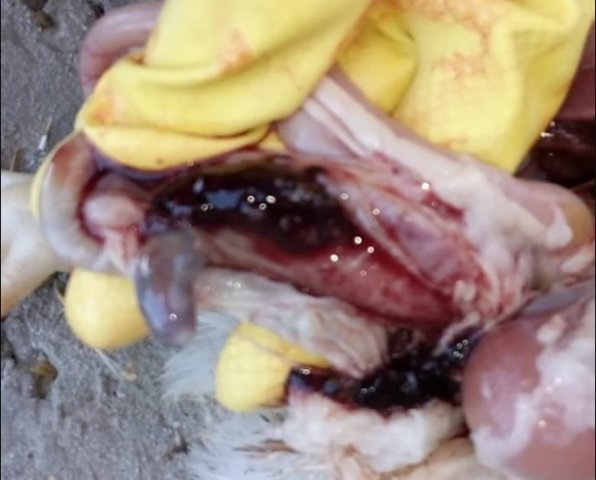
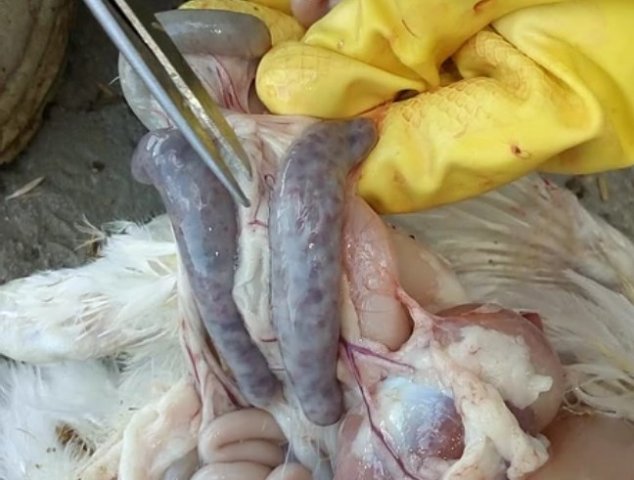
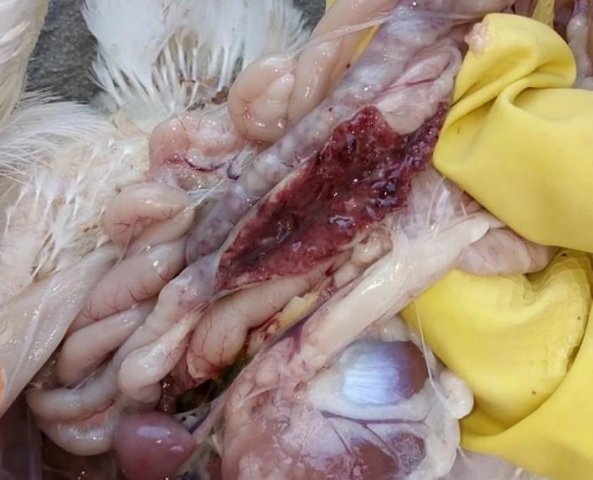
Кокцидиоз птиц
Кокцидиоз у кур встречается достаточно часто, особенно на крупных птицефабриках. Болезнь поражает молодняк, смертность которого может достигать 80% от общей массы поголовья. В экономическом плане такие потери крайне неуместны. Как предупредить заболевание и обезопасить хозяйство?
Этиология.
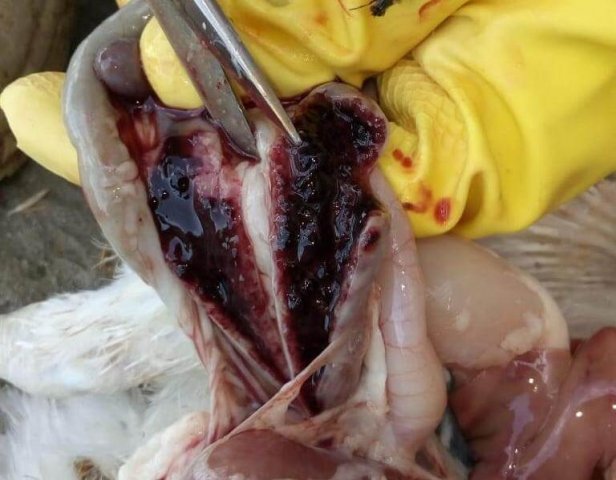
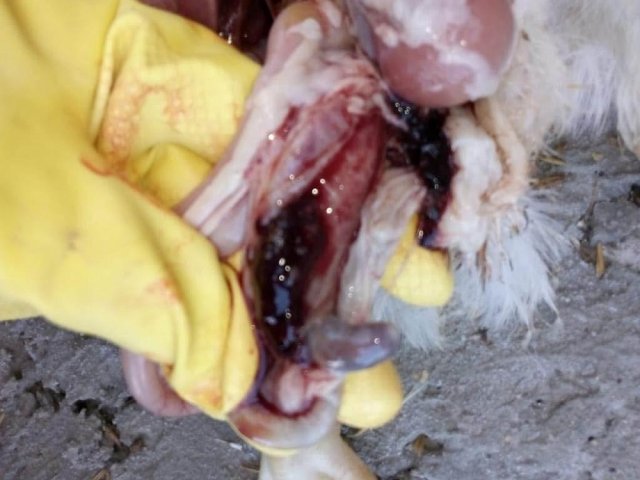
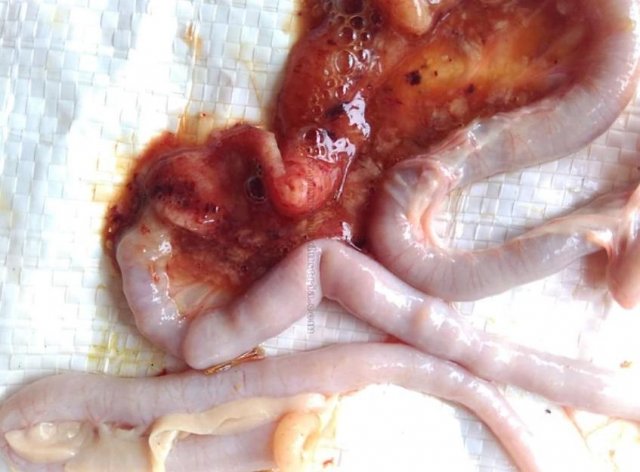
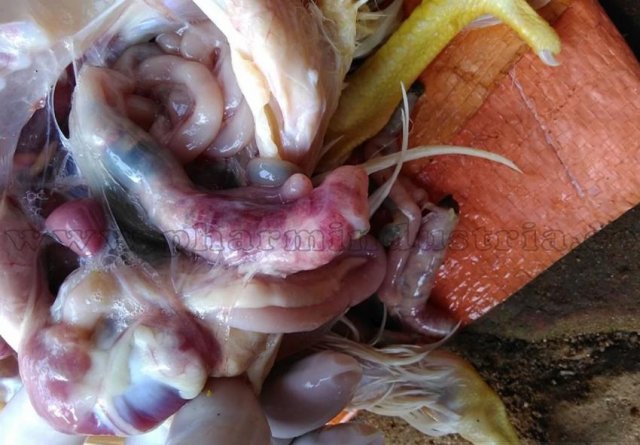
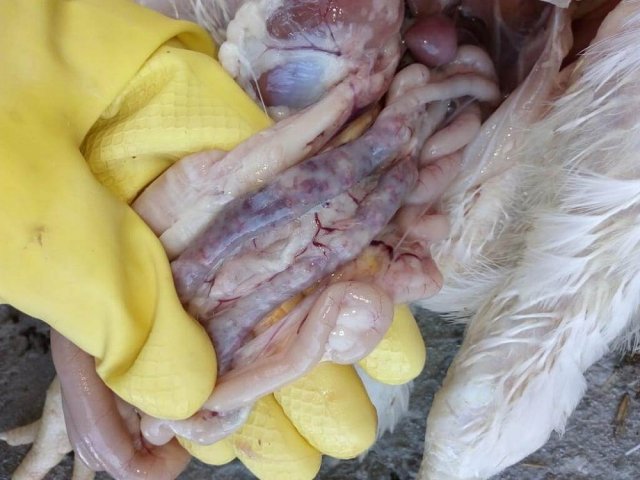
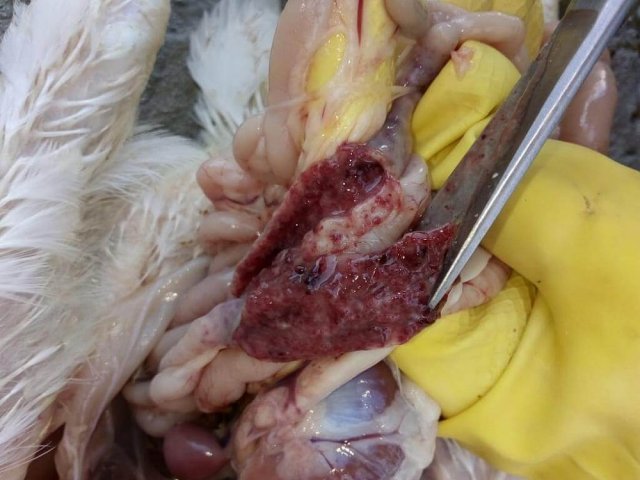
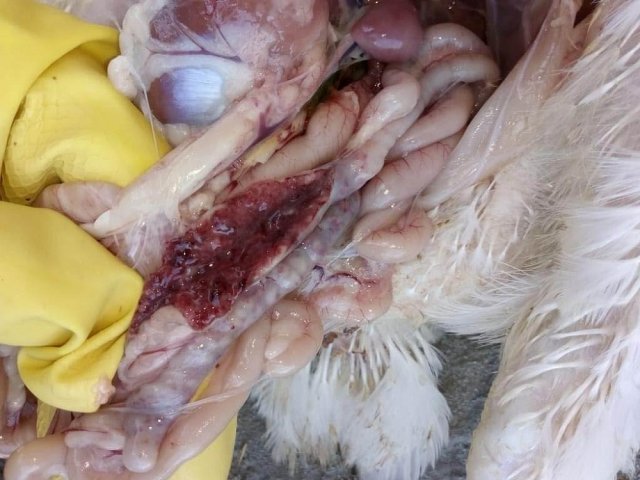
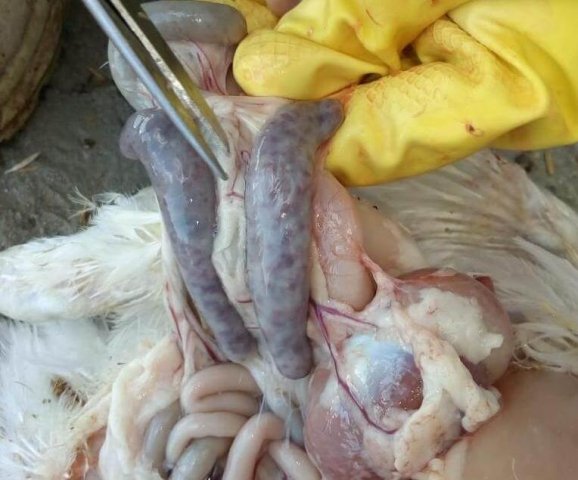
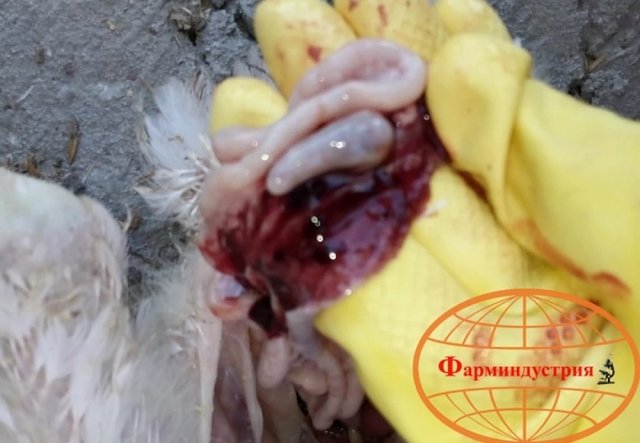
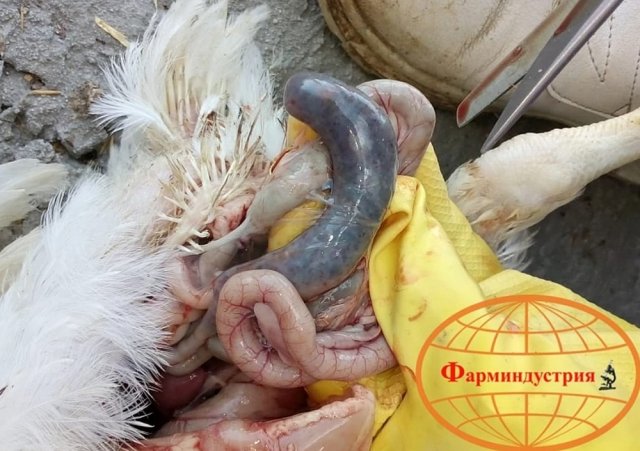
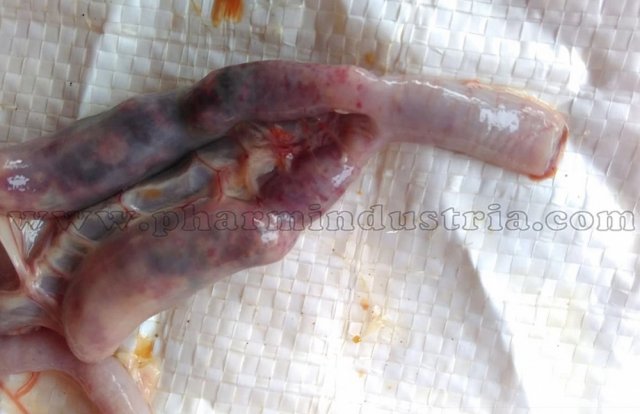
Возбудитель данной патологии – простейшее одноклеточное именуемое кокцидией. У кур заболевание провоцирует более 10 разновидностей паразита, среди которых наиболее патогенны: Eimeria tenella – поражает слепые отростки кишечника; E. Necatrix, E. Brunette, E. Maxima – поражают тонкий кишечник, так же прямую кишку и клоаку; при попадании таких слабовирулентных эймерий, как E. Mitis, E. Praecox – болезнь носит хроническое течение. Одна птица может одновременно заразиться разными видами кокцидий. К болезни наиболее восприимчив молодняк возрастом до полутора месяца, реже – до полугода. Болезнь протекает остро, в тяжёлой форме, летальность у цыплят может достигать 80-100%. Взрослая птица, хотя и заражается кокцидиозом, но клинически это никак не проявляется, может наблюдаться снижение продуктивности и яйценоскости. У кур – бройлеров снижается привес.
Причины заражения кокцидиозом.
- больные цыплята,
- недавно переболевший молодняк,
- взрослые куры-носители;
- скудный рацион;
- повышенные температурные показатели в курятнике;
- повышенная влажность воздуха, сырость;
- трава, используемая в качестве корма, заражённая ооцистами кокцидий;
- заражённая почва в вольерах для выгула;
- заражённая, своевременно не убранная подстилка в курятнике;
- загрязнённый инвентарь, сменная одежда персонала и посуда;
- ооцисты могут распространять грызуны, насекомые.
Стадии и симптомы кокцидиоза у кур.
Кокцидии имеют сложный цикл развития. Клинические проявления болезни меняются, в зависимости от стадии их развития в организме птицы:
Первая стадия
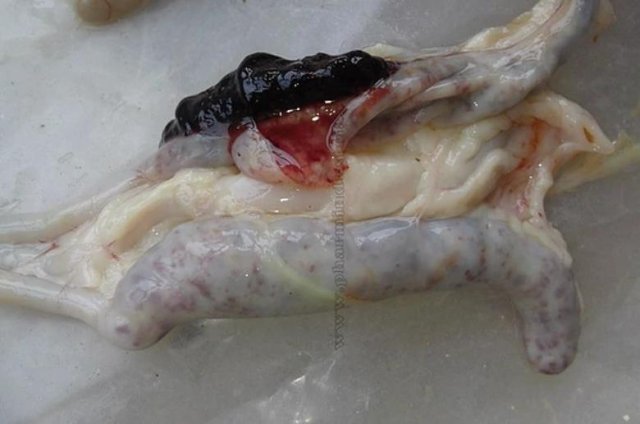
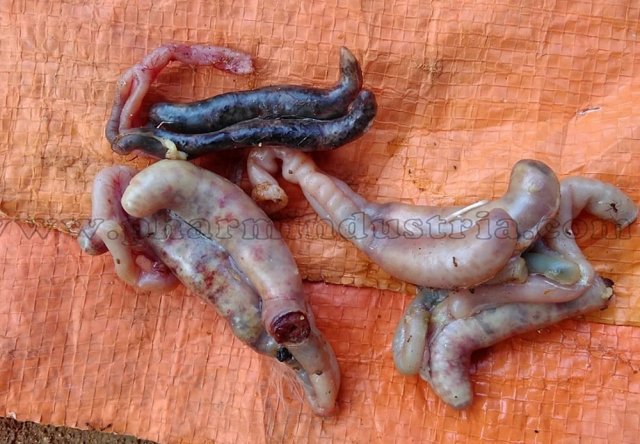
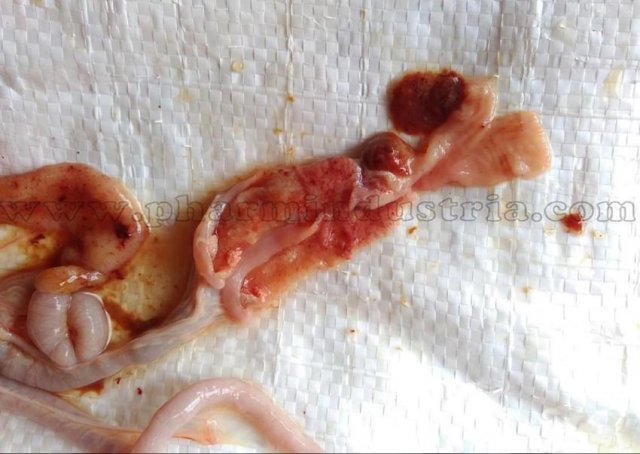
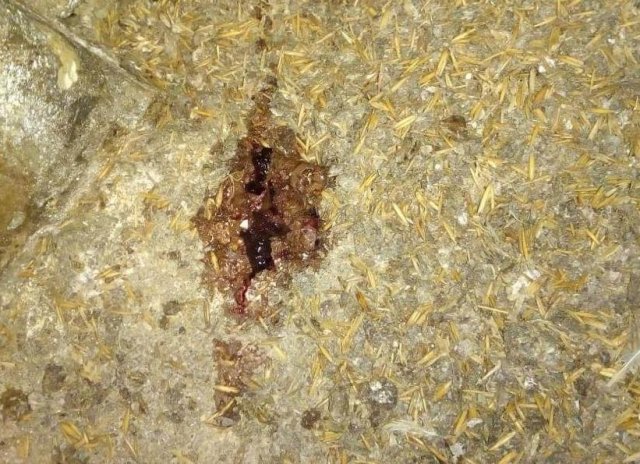
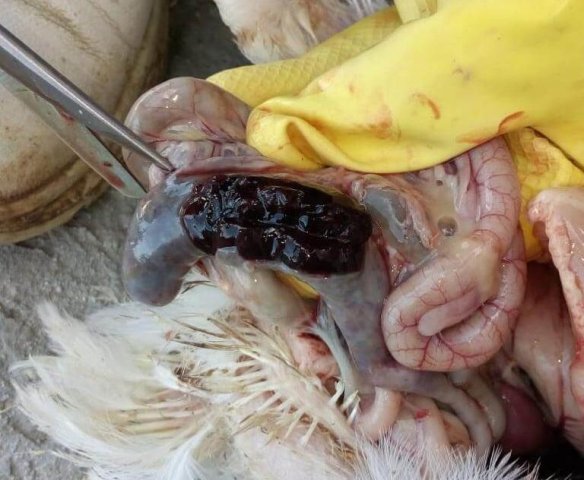
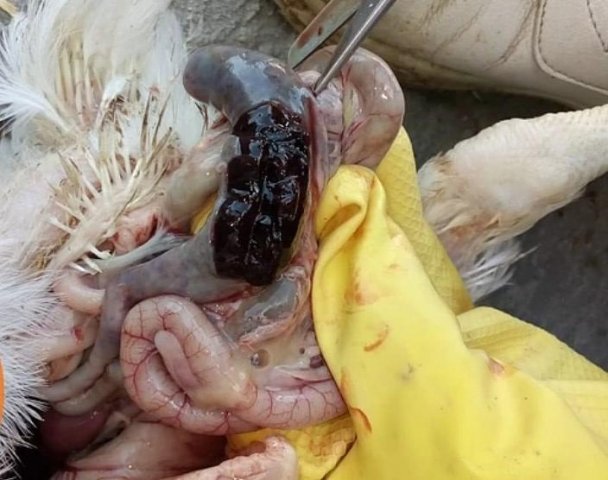
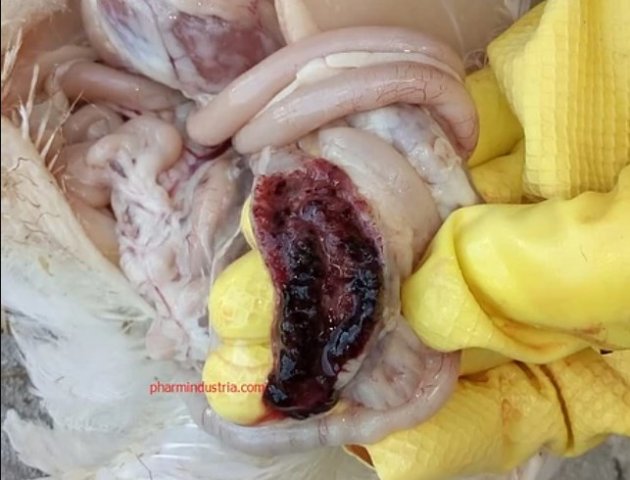
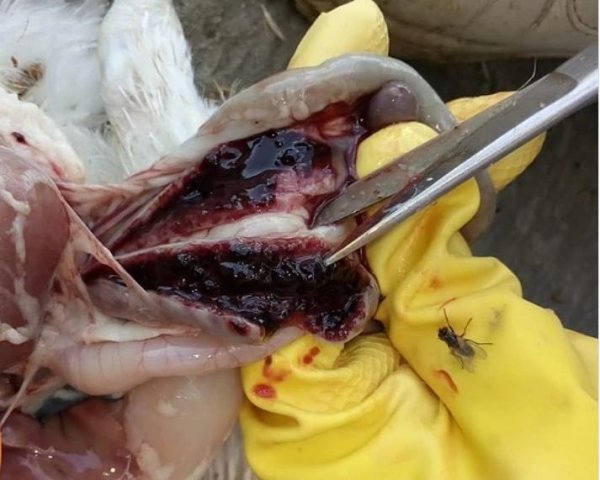
Характеризуется проникновением эймерий в подслизистую оболочку кишечника, где они начинают размножение. Период длится примерно 5 суток, в течение которых паразит разрушает ткани кишечника, вызывая кровотечения и воспалительную реакцию.
Начальная стадия может закончиться по разным сценариям: В случае правильного функционирования иммунных сил организма, птица переболевает в слабой форме с мало выраженными симптомами (абортивная форма). Наблюдается подавление жизнедеятельности кокцидий и полное выздоровление. При низких показателях иммунитета происходит активное размножение эймерий, с последующим распространением паразита в другие органы. Далее происходит переход на следующую стадию.
Вторая стадия
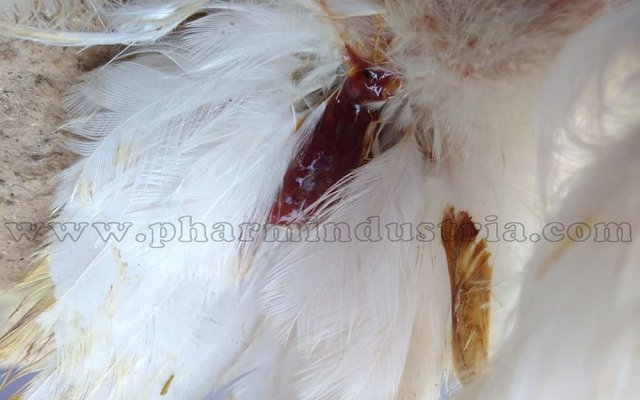
- общая слабость – молодняк взъерошен, основное время проводят сидя;
- полный отказ от корма, быстрое исхудание;
- отмечается бледность видимых слизистых оболочек;
- диарея, цвет фекалий различных оттенков;
- угнетённое состояние.
Третья стадия
Третья стадия характеризуется ослаблением негативного воздействия кокцидий на организм, подавлением их жизнедеятельности и постепенным выздоровлением. В этой стадии кровотечение в кишечнике прекращается, нормализуется кроветворение. Существует опасность гибели птицы из-за дистрофических изменений.
Четвёртая стадия
В четвёртой стадии отмечается полное восстановление иммунитета и обменных процессов. Работа кишечника и органов налаживается, нормализуется аппетит и пищеварение.
Диагностика кокцидиоза у птицы.
- эпизоотологическую картину;
- клинические проявления;
- патологоанатомические изменения;
- лабораторные данные, которые показывают наличие эймерий на разной стадии своего развития в кале.
Методы профилактики.
- ооцисты кокцидий обладают высокой выживаемостью в меняющихся условиях внешней среды;
- дезинфицирующие средства, применяемые в ветеринарии, часто бессильны – ооцисты проявляют сильную устойчивость к ним;
- эймерии очень быстро размножаются.
Главные меры успешной профилактики:
- Перед заселением птицы необходимо подготовить помещение и инвентарь.
- Для этого поверхности необходимо обработать кипятком или паром, так же подойдет 7% раствор аммиака (после применения аммиака необходимо проветрить помещение на протяжение 3 часов после обработки, поилки и посуду промыть).
- Молодняк до 2-месячного возраста рекомендуется держать изолированно от взрослого поголовья.
- Клеточное содержание цыплят, не достигших 8-недельного возраста.
- Следить за чистотой и сухостью подстилки в курятнике.
- Содержащийся на подстилке молодняк должен получать в корм химиопрофилактические препараты, начиная с 10-дневного возраста.
Конечно, данные рекомендации не решат полностью проблему кокцидиоза в хозяйстве, но значительно снизят риск глобального распространения паразитов. В связи с риском привыкания к кокцидиостатикам, разработаны вакцины против кокцидий – Кокцивак, Иммукокс, Ливакокс. Неудобства в применении составляет высокая стоимость, поэтому ими в основном прививают кур-несушек и ремонтный молодняк.
Кокцидиоз – распространённая проблема. Полностью избавится от паразита хоть и не представляется возможным, но поддержание правильных санитарно-гигиенических показателей главная цель. Выполнение рекомендаций ветеринарного врача и своевременная обработка помещений – залог высокой продуктивности и здоровья птицы.
Источник