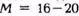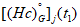- Молекулярная масса природного газа
- Физико-химические свойства природных газов. Пересчет состава газа и конденсата , страница 2
- Нефтяные газы и их свойства
- 12 Таблицы данных
- «ГОСТ 31369-2021 (ISO 6976:2016). Межгосударственный стандарт. Газ природный. Вычисление теплоты сгорания, плотности, относительной плотности и числа Воббе на основе компонентного состава» (введен в действие Приказом Росстандарта от 12.10.2021 N 1106-ст)
Молекулярная масса природного газа
Природные углеводородные газы представляют собой смесь предельных УВ вида СnН2n+2. Основным компонентом является метан СН4. наряду с метаном в состав природных газов входят более тяжелые УВ, а также неуглеводородные компоненты: азот N, углекислый газ СО2, сероводород H2S, гелий Не, аргон Аг.
Природные газы подразделяют на следующие группы.
1. Газ чисто газовых месторождений, представляющий собой сухой газ, почти свободный от тяжелых УВ.
2. Газы, добываемые из газоконденсатных месторождений,смесь сухого газа и жидкого углеводородного конденсата. Углеводородный конденсат с остоит из С5+высш.
3. Газы, добываемые вместе с нефтью (растворенные газы). Это физические смеси сухого газа, пропан-бутановой фракции (жирного газа) и газового бензина.
Компонентный состав природного газа трех месторождений приведен в табл. 1.
| Месторождение | СН4 | С2Н6 | С3Н8 | С4Н10 | С5+высш |
| Газлинское (сухой газ) | 97,2 | 1,3 | 0,9 | 0,47 | 0,13 |
| Вуктыльское (газоконденсат) | 71,8 | 8,7 | 3,9 | 2,8 | 12,8 |
| Мухановское (попутный газ | 32,1 | 20,2 | 23,6 | 10,6 | 13,5 |
Газ, в составе которого УВ (С3, С4) составляют не более 75 г/м 3 , называют сухим. При содержании более тяжелых УВ (свыше 150 г/м 3 ) газ называют жирным.
Газовые смеси характеризуются массовыми или молярными концентрациями компонентов. Для характеристики газовой смеси необходимо знать ее среднюю молекулярную массу, среднюю плотность или относительную плотность по воздуху
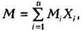 |
где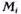
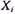
Для реальных газов обычно
Источник
Физико-химические свойства природных газов. Пересчет состава газа и конденсата , страница 2
В газовой промышленности за стандарт приняты условия Т=293,15 0 К и Р=0,1013 МПа, в этом случае 1 гмоль и 1 кгмоль будут занимать объемы соответственно 24,04 дм 3 /моль и 24,04 м 3 /кмоль.
Для природного газа, являющегося смесью углеводородных и неуглеводородных компонентов, вводится понятие кажущаяся молярная масса Мк, значение которой определяется по формуле
где Мi – молярная масса i-го компонента, кг/кмоль; ni — молярная масса i-го компонента в смеси; к – число компонентов в смеси.
Если ni дано в мольных процентах, формула имеет вид:
Иногда используют единицы измерения г/моль. Часто слово “кажущаяся” опускается и для природного газа это значение называют молярная (а иногда молекулярная) масса газа.
Плотность вещества – масса единицы объема. Плотность газа определяется, как отношение молярной массы к объему моля газа, т.е.
При стандартных условиях – ρст
где ρ0 и ρст – плотность газа при соответствующих условиях.
2.2. Пересчет состава газа и конденсата.
Пересчет состава газа и конденсата осуществляется следующим образом.
Дан состав газа (конденсата) в мольных долях – ∑Мi=1, где ni – мольная масса i-го компонента в смеси, к – число компонентов в смеси. При известной молярной массе Мi – каждого компонента определить состав в массовых долях, т.е. найти mi и ∑mi=1, mi – массовая доля i-го компонента. Решение приводится в таблице 2.2.
Таблица 2.2 – Пересчет мольного состава смеси углеводородов в массовый.
Мольные доли, ni
Молярная масса, mi
Масса i-го компонента
Источник
Нефтяные газы и их свойства
Природные углеводородные газы находятся в недрах земли или в виде самостоятельных залежей, образуя чисто газовые месторождения, либо в растворенном виде содержится в нефтяных залежах. Такие газы называются нефтяными или попутными, так как их добывают попутно с нефтью.
Природные нефтяные газы – смеси предельных углеводородов, главной составляющей которой является метан. В виде примесей в природном газе присутствуют азот, углекислый газ, сероводород, меркаптаны, гелий, аргон и пары ртути.
Физические свойства природного газа зависят от его состава, но в целом они близки к свойствам метана, как основного компонента смеси.
Попутные газы месторождений Муравленковского региона содержат от 59,7 % до 84 % метана.
Молекулярная масса газа: 16-20 кг/кмоль.
Плотность газа: 0,73 – 1 т/м 3 .
При расчетах пользуются относительной плотностью -плотность газа, взятая по отношению к плотности воздуха.Относительная плотность нефтяных газов колеблется от 0.554 для метана до 2.49 для пентана и выше. Чем больше в нефтяном газе легких углеводородов — метана СН4 и этана С2Н6 (относительная плотность — 1.038), тем легче этот газ. При нормальных условиях метан и этан находятся в газообразном состоянии. Следующими за ними по относительной плотности являются пропан С3Н8 (1.522) и бутан С4Н0 (2.006), которые также относятся к газам, но легко переходят в жидкость даже при небольших давлениях.
Относительная плотность попутных газов Муравленковского региона варьируется от 0,763 до 1,029.
Вязкость нефтяного газа при давлении 0,1 МПа и температуре 0 0 С обычно не превышает 0,01 МПа·с. С повышением давления и температуры она незначительно увеличивается. Однако при давлениях выше 3 МПа увеличение температуры вызывает понижение вязкости газа, причем газы, содержащие более тяжелые углеводороды, как правило, имеют большую вязкость.
Теплоемкость газа. Теплоемкостью называется количество тепла, необходимое для нагревания единицы веса или объема этого вещества на 1 0 С. Весовая теплоемкость газа измеряется в кДж/кг∙град, а объемная в кДж/м 3 ∙град.
Теплота сгорания газа. Теплота сгорания какого-либо вещества определяется количеством тепла, выделяющимся при сжигании единицы веса или единицы объема данного вещества. Теплота сгорания газов выражается в кДж/кг и кДж/м 3 и является основным показателем, характеризующим газ или топливо. Если при постоянной температуре повышать давление какого-либо газа, то после достижения определенного значения давления этот газ сконденсируется, т.е. перейдет в жидкость. Для каждого газа существует определенная предельная температура, выше которой ни при каком давлении газ нельзя перевести в жидкое состояние.
Наибольшая температура, при которой газ не переходит в жидкое состояние, как бы велико ни было давление, называется критической температурой.
Природный газ — смесь газов. Компонентами природного газа являются углеводороды парафинового ряда: метан, этан, пропан, изобутан, а также неуглеводородные газы: сероводород, углекислый газ, азот. При эксплуатации газовых и газоконденсатных месторождений в скважинах, газосборных сетях, магистральном газопроводе при определенных термодинамических условиях образуется кристаллогидраты. По внешнему виду они похожи на сажеобразную массу или лед. Гидраты образуются при наличии капельной влаги и определенных давлениях и температурах. В зависимости от преобладания в нефтяных газах легких (метан, этан) или тяжелых (пропан и выше) углеводородов газы разделяются на:
Сухие -природный газ, который не содержит тяжелых углеводородов или содержит их в незначительных количествах.
Жирные — газ, содержащий тяжелые углеводороды в таких количествах, когда из него целесообразно получать сжиженные газы или газовые бензины.
На практике принято считать жирным газом такой, в 1 м 3 которого содержится более 60 гр газового бензина. При меньшем содержании газового бензина газ называют сухим. С тяжелыми нефтями добывают преимущественно сухой газ, состоящий главным образом из метана. В нефтяных газах, кроме углеводородов, содержатся в незначительных количествах углекислый газ, сероводород и др. Важной характеристикой природного газа является растворимость его в нефти.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник
12 Таблицы данных
«ГОСТ 31369-2021 (ISO 6976:2016). Межгосударственный стандарт. Газ природный. Вычисление теплоты сгорания, плотности, относительной плотности и числа Воббе на основе компонентного состава» (введен в действие Приказом Росстандарта от 12.10.2021 N 1106-ст)
Молярная масса и индексы числа атомов
для компонентов природного газа
Молярная масса, Mj, кг·кмоль -1
Примечание — Значения молярной массы, приведенные выше, получены взвешенным суммированием атомных масс (атомных весов) входящих в молекулу элементов, в соответствии с таблицей A.2 приложения A. Все десятичные знаки оставлены в этой таблице, т.е. округление до определенного числа знаков после запятой не применялось (за исключением воздуха). Значения стандартной неопределенности для молярных масс в данную таблицу не включены. При необходимости их вычисляют по формуле (27).
Коэффициенты суммирования для компонентов природного газа
при различных стандартных температурах измерений
Коэффициенты суммирования sj при различных стандартных температурах измерений
Примечание — Значения sj и u(sj), приведенные выше, относятся к давлению p0, равному 101,325 кПа.
Высшая молярная теплота сгорания для компонентов
природного газа при различных стандартных температурах
сгорания для идеального газа
Высшая теплота сгорания , кДж·моль -1 , идеального газа при различных стандартных температурах
1 Все значения для t1 = 25 °C взяты из [1], за исключением метана (j = 1), воды (см. примечание 2) и н-алканов C11 — C15. Значения для t1 = 20 °C, 15,55 °C, 15 °C и 0 °C получены путем пересчета из соответствующих значений при 25 °C.
2 Не равная нулю теплота сгорания воды (j = 42) выведена формально из определения высшей теплоты сгорания при условии конденсации до жидкого состояния всего водяного пара в продуктах горения. Таким образом, любой присутствующий водяной пар в газе вносит свой вклад скрытой теплоты испарения в высшую теплоту сгорания смеси. Значения стандартной энтальпии испарения воды приведены в таблице A.5 приложения A.
Источник