- 12 Таблицы данных
- «ГОСТ 31369-2021 (ISO 6976:2016). Межгосударственный стандарт. Газ природный. Вычисление теплоты сгорания, плотности, относительной плотности и числа Воббе на основе компонентного состава» (введен в действие Приказом Росстандарта от 12.10.2021 N 1106-ст)
- Молекулярная масса природного газа
12 Таблицы данных
«ГОСТ 31369-2021 (ISO 6976:2016). Межгосударственный стандарт. Газ природный. Вычисление теплоты сгорания, плотности, относительной плотности и числа Воббе на основе компонентного состава» (введен в действие Приказом Росстандарта от 12.10.2021 N 1106-ст)
Молярная масса и индексы числа атомов
для компонентов природного газа
Молярная масса, Mj, кг·кмоль -1
Примечание — Значения молярной массы, приведенные выше, получены взвешенным суммированием атомных масс (атомных весов) входящих в молекулу элементов, в соответствии с таблицей A.2 приложения A. Все десятичные знаки оставлены в этой таблице, т.е. округление до определенного числа знаков после запятой не применялось (за исключением воздуха). Значения стандартной неопределенности для молярных масс в данную таблицу не включены. При необходимости их вычисляют по формуле (27).
Коэффициенты суммирования для компонентов природного газа
при различных стандартных температурах измерений
Коэффициенты суммирования sj при различных стандартных температурах измерений
Примечание — Значения sj и u(sj), приведенные выше, относятся к давлению p0, равному 101,325 кПа.
Высшая молярная теплота сгорания для компонентов
природного газа при различных стандартных температурах
сгорания для идеального газа
Высшая теплота сгорания , кДж·моль -1 , идеального газа при различных стандартных температурах
1 Все значения для t1 = 25 °C взяты из [1], за исключением метана (j = 1), воды (см. примечание 2) и н-алканов C11 — C15. Значения для t1 = 20 °C, 15,55 °C, 15 °C и 0 °C получены путем пересчета из соответствующих значений при 25 °C.
2 Не равная нулю теплота сгорания воды (j = 42) выведена формально из определения высшей теплоты сгорания при условии конденсации до жидкого состояния всего водяного пара в продуктах горения. Таким образом, любой присутствующий водяной пар в газе вносит свой вклад скрытой теплоты испарения в высшую теплоту сгорания смеси. Значения стандартной энтальпии испарения воды приведены в таблице A.5 приложения A.
Источник
Молекулярная масса природного газа
Природные углеводородные газы представляют собой смесь предельных УВ вида СnН2n+2. Основным компонентом является метан СН4. наряду с метаном в состав природных газов входят более тяжелые УВ, а также неуглеводородные компоненты: азот N, углекислый газ СО2, сероводород H2S, гелий Не, аргон Аг.
Природные газы подразделяют на следующие группы.
1. Газ чисто газовых месторождений, представляющий собой сухой газ, почти свободный от тяжелых УВ.
2. Газы, добываемые из газоконденсатных месторождений,смесь сухого газа и жидкого углеводородного конденсата. Углеводородный конденсат с остоит из С5+высш.
3. Газы, добываемые вместе с нефтью (растворенные газы). Это физические смеси сухого газа, пропан-бутановой фракции (жирного газа) и газового бензина.
Компонентный состав природного газа трех месторождений приведен в табл. 1.
| Месторождение | СН4 | С2Н6 | С3Н8 | С4Н10 | С5+высш |
| Газлинское (сухой газ) | 97,2 | 1,3 | 0,9 | 0,47 | 0,13 |
| Вуктыльское (газоконденсат) | 71,8 | 8,7 | 3,9 | 2,8 | 12,8 |
| Мухановское (попутный газ | 32,1 | 20,2 | 23,6 | 10,6 | 13,5 |
Газ, в составе которого УВ (С3, С4) составляют не более 75 г/м 3 , называют сухим. При содержании более тяжелых УВ (свыше 150 г/м 3 ) газ называют жирным.
Газовые смеси характеризуются массовыми или молярными концентрациями компонентов. Для характеристики газовой смеси необходимо знать ее среднюю молекулярную массу, среднюю плотность или относительную плотность по воздуху
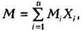 |
где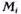
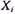
Для реальных газов обычно
Источник