Состав и основные параметры природных газов
Природные газы, добываемые из газовых и газоконденсатных месторождений, состоят из предельных углеводородов с общей формулой CnH2n+2 и неуглеводородных компонентов: азота (N2), углекислого газа (СО2), сероводорода (H2S), инертных газов (гелия, аргона, криптона, ксенона). Кроме того, природные газы насыщены парами воды, содержание которых зависит от давления, температуры, состава газа и воды. Число углеродных атомов в молекуле углеводородов п может достигать 17-40.
Метан (СН4), этан (С2Н6), этилен (С2Н4) при нормальных условиях (Рат = 0,1 МПа и Тст = 273К) являются реальными газами. Пропан (С3Н8), бутан (С4Н10) в нормальных условиях находятся в газообразном состоянии, при повышенных давлениях — в жидком состоянии, входят в состав сжиженных углеводородных газов. Углеводороды от (С5Н12) до (С17Н36) при нормальных условиях находятся в жидком состоянии. Все компоненты, входящие в состав природного газа, характеризуются строго индивидуальными свойствами.
По составу компонентов природные газы можно подразделить на три группы:
1. Газы, добываемые из чисто газовых месторождений. Это сухие
газы без тяжелых углеводородов.
2. Газы, добываемые с нефтью (попутный нефтяной газ), это физическая смесь сухого газа, сжиженного газа и газового бензина.
3. Газы, добываемые из газоконденсатных месторождений. Они со
стоят из сухого газа и жидкого углеводородного конденсата.
Наименьшей частицей, характеризующей вещество, является молекула, состоящая из атомов одного или нескольких элементов. За единицу измерения массы атомов и молекул условно принята 1/12 массы атома изотопа углерода. Масса атома элемента, выраженная в углеродных единицах, называется атомной массой элемента. Сумма атомных масс атомов, образующих молекулу, называется молекулярной массой вещества. Состав природного газа выражается в объемных или массовых долях единицы или процентах. Объемный состав примерно совпадает с молярным, так как объем 1.кмоля идеального газа при одинаковых физических условиях, по закону Авогадро, имеет одно и то же численное значение, в частности, при нормальных условиях равен 22,41 м 3 .
Объемный (молярный) состав газа можно пересчитать в массовый для каждого компонента смеси по формуле
где gi, — массовая доля i-гo компонента в газе;
Xi — объемная доля i-гo компонента;
Мi — молекулярная масса i-гo компонента.
Если состав природного газа задан в массовых долях, то для пересчета его в объемные (молярные) единицы используется формула
где mi — число молей i-гo компонента в смеси, и mi=gi / Mi.
Одним из основных параметров, характеризующим природный газ, является плотность. Плотность газа — масса единицы объема — равна отношению молекулярной массы газа к объему 1 моля. Плотность определяется по формуле
Размерность плотности в системе СИ — кг/м 3 , в системе СГС — г/см 3 .
Плотность газа известного состава определяется как сумма произведений плотности отдельных компонентов на их объемное (молярное) содержание Xi:
или по известным молекулярным массам:
Для практических расчетов часто используется относительная плотность газа по воздуху , равная отношению плотности газа к плотности воздуха , взятой при том же давлении и температуре:
т.к. при нормальных условиях равна 1.293 кг/м 3 . Относительная плотность удобна тем, что не зависит от температуры, давления.
Плотность природных газов при различных давлениях и температурах определяют по формуле
где z — коэффициент сверхсжимаемости природного газа.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник
9. Состав природных газов и их классификация. Молекулярный объем (масса), плотность, вязкость, упругость насыщенных паров природных газов.
Природные газы подразделяют на три группы. 1. Газы, добываемые из чисто газовых месторождений. Они представляют собой сухой газ, практически свободный от тяжелых углеводородов. В составе газа чисто газовых месторожд. наход. 91…99% метана, остальные 1…9% гомологи метана, а также в состав чисто газовых месторожд. входят и не Ув-ые газы: это N2 до 42% , Н2S, меркаптаны, СО2 и такие редкие газы как Ar, He, ксинон, криптон и т.д.
2. Газы, добываемые вместе с нефтью. Это физическая смесь сухого газа, пропан-бутановой фракции (сжиженного газа) и газового бензина. В составе попутных газов нефт. мест. сод-ие СН4 сост.< 35…40%, содерж. гомологов доходит до 30…60%, мн. N2, СО2 иногда и Н2S.
3. Газы, добываемые из газоконденсатных месторождений. Они состоят из сухого газа и жидкого углеводородного конденсата. Углеводородный конденсат состоит из большого числа тяжелых углеводородов, из которых можно выделить бензиновые, лигроиновые, керосиновые, а иногда и более тяжелые масляные фракции. Кроме того, присутствуют N2, СО2, H2S, Не, Аг и др. В составе газов, добываемых из газоконденсатных месторождений, содержание СН4 колеблется от 75 до 88%, остальные гомологи метана не УВ компоненты.
Состав газовой смеси выраж-ся в виде массовой или объемной концентрацией компонентов либо в мольных долях.1. Массовая конц-ия комп-ов:
Wi – массовая конц-ия i-го компонента; Мi— масса i-го компонента, входящего в состав газов. Смеси; n-кол-во комп-ов, вход-их в состав газов. 2. Объемная конц-ия компонентов
V-объемн. конц-ия; Vi— объем i-го комп-та в сост. смеси; n- число компонентов в смеси. 3. Мольная доля.
Yi – мольная доля i-го компонента; n I –число молей i-го комп-та. Плотность газа – это масса газа в единицу объема, измеряется в кг/м 3 , но часто пользуются относительной плотностью газа. За относительную плотность газа принимается число, показывающие во сколько раз масса рассматриваемого газа> или< массы сухого воздуха, заключ. В один и тот же объём при н.у. (0 0 С; 0,1 МПа.)г в
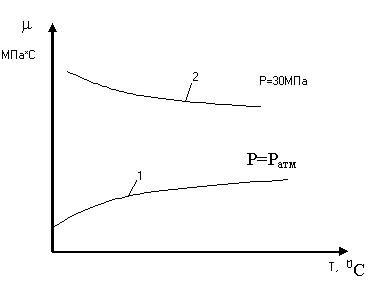
Чем > молекулярная масса газа, тем > его плотность. Плотность газов измеряют специальными газовыми пикнометрами или эффузивным способом, основанным на измерении скорости истечения газов из калиброванных отверстий. Плотность газов зависит от t-ры и давления. С увеличением t-ры плотность газов уменьшится, с ростом Р и молекулярной массы плотность увеличивается. Сведения о плотности газов использ. для опред-ия массы газа по объему и наоборот. Вязкость УВ газов. — характеризует силу внутреннего трения. Различают динамическую и кинематическую вязкость, кот. связаны м/у собой следующим отношением: (1) v- [м 2/ с]-кинематическая вязкость; μ-[Па*с]- динамическая вязкость. Вязкость газа зависит от t, P и природы самого газа. Закономерности изменения в. газов от указанных параметров можно объяснить исходя из некот. положений кинетич. теории газов. Так известно, что вязкость (2) ρ-плотность газа; — ср. скорость движения молекул газа; — длина свободного пробега молекул; μ -динамич. вязкость;
Согласно ф-ле (2) с повышением Р плотность газа увеличивается, но при этом уменьшается средняя длина свободного пробега молекул, а средняя их скорость не изменяется , поэтому с увеличением Р динамич. вязкость газа в начале практически остается постоянной.
При высоких давлениях это нарушается, т.к. газ по своим св-ам приближается к жидкостям. Из формулы (2) видно, что с увеличением t-ры вязкость газа должна возрастать, т.к. ср. скорость движения молекул увелич-ся, а плотность и ср.длина пробега остаются постоянными, при неизменном объеме газа . С повышением t-ры увеличивается скорость и количество движения передаваемого из слоя в слой в ед. времени и следует, что больше будет вязкость.
Однако с повышением Р эти закономерности нарушается. При высоких Р с увеличением t вязкость газов изменяется аналогично изменению вязкости ж-ти, т.е. вязкость снижается.
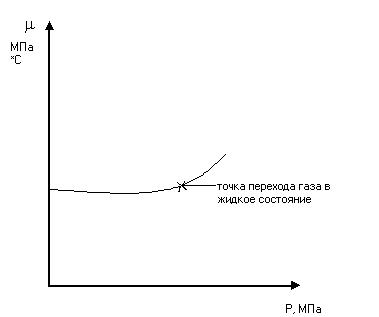
С увеличением молекулярной массы газа вязкость его возрастает. Для определения вязкости газов используются следующие методы:1. капиллярный;2. м-д измерения ск-ти падения шарика в исследован.газе. 3. м-ды, основан. на измерении ск-ти вращения цил-ров и затухания вращ-ых колебаний дисков; 4. рассчетные м-ды. Упругость насыщенных паров УВ-ых газов. — это то минимальное давление, при кот. газ начин. переходить в жидкое состояние Ру [Па, МПа]. Упругость насыщенных паров увеличивается с увеличением t-ры и она тем больше , чем меньше плотность газов. С ростом молекулярного веса упругость насыщенных паров уменьшается.(Например:1. бутан С4Н10— 0,22МПа;2. пропан С3Н8— 0,82МПа;3. этан С2Н8— 4,0 МПа;4. метан СН4— 27,0МПа.)
Источник