- 3. Белки – как биополимеры. Строение белковых молекул
- Строение и свойства белков
- 3. Основные биополимеры и их мономеры
- 4. Общая характеристика метаболических процессов
- Раздел 2. Белковые вещества Лекция 2. Общая характеристика белков и аминокислот. Строение, классификация и свойства аминокислот
- 1. Общая характеристика аминокислот
3. Белки – как биополимеры. Строение белковых молекул
Белки – высокомолекулярные органические соединения, состоящие из α-аминокислот, соединенных пептидными связями.
По химическому составу белки делят на две основные группы. К первой группе – протеины – относятся те белки, при гидролизе которых образуются только аминокислоты. Вторую группу – протеиды – составляют белки, при гидролизе которых помимо аминокислот образуются и другие соединения, например, липиды, углеводы, фосфорные кислоты и др.
В состав белков входит свыше 20 различных аминокислот. Все белки сильно различаются между собой по качественному и количественному составу различных аминокислот, по взаиморасположению аминокислотных остатков.
В тканях и органах человека и животных могут синтезироваться 12 α-аминокислот (заменимые аминокислоты), 8 α-аминокислот в организме человека и животных не синтезируются (незаменимые аминокислоты) и должны поступать в организм с пищей.
Строение белковых молекул
Различают четыре уровня структурной организации белковых молекул.
Первичная структура белка — это число и последовательность аминокислотных остатков в полипептидной цепи. (Полипептидную теорию строения белков предложил немецкий химик Э. Фишер в начале XX в.).
В организме человека свыше 10000 различных белков, и все они построены из одних и тех же 20 α-аминокислот, которые соединены между собой пептидными связями. Число остатков аминокислот в молекулах белков варьирует от 50 до 10. Потенциально возможное число белков с различной первичной структурой практически не ограничено.
Один из первых белков, первичная структура которого была установлена в 1954 г., — гормон инсулин (регулирует содержание сахара в крови), его молекула состоит из двух полипептидных цепей, которые связаны друг с другом (в одной цепи 21 аминокислотный остаток, в другой — 30).
Другой белок — фермент рибонуклеаза — состоит из 124 аминокислотных остатков и имеет Mr = 15000. Белок крови — гемоглобин — имеет Мr = 68000. Белки некоторых вирусов имеют Мr до 50 млн. Относительная молекулярная масса белков изменяется в широких пределах: от 5 тыс. до десятков миллионов.
Вторичная структура белка (для большинства белков) — это α-спираль, которая образуется в результате скручивания полипептидной цепи за счет водородных связей между группами: —СО— и —NН—
Теоретически все —СО— и —NH— группы могут участвовать в образовании водородных связей, поэтому вторичная структура очень стабильна.
Вторичная структура была установлена американским химиком Л. Полингом в 1951 г.
Существуют белки, имеющие другие типы вторичной структуры.
Третичная структура белка — пространственная конфигурация спирали.
У большинства белков полипептидные цепи свернуты особым образом в «клубок» — компактную «глобулу». Эта структура поддерживается за счет гидрофобных взаимодействий, а также водородных, дисульфидных, ионных и других связей.
В количественном отношении наиболее важны гидрофобные (от греч. гидро — вода, фобос — страх) взаимодействия. Белок в водном растворе свертывается таким образом, чтобы его гидрофобные (водоотталкивающие) боковые цепи были внутри молекулы, а гидрофильные (растворимые) — повернуты наружу.
В результате взаимодействия между различными функциональными группами полипептидной цепи образуются дисульфидные мостики — S— S— , в создании которых участвуют атомы серы серосодержащих аминокислот (например, цистеина); солевые мостики—получаются при взаимодействии карбоксильных и аминогрупп, сложноэфирные мостики—результат взаимодействия карбоксильных и гидроксильных групп.
Существуют белки, у которых третичная структура почти или совсем не выражена.
Четвертичная структура белка — способ совместной укладки нескольких полипептидных цепей; образующиеся структуры называются ассоциатами.
Например, гемоглобин (белок крови) — это сложный белок, макромолекула которого состоит из четырех полипептидных цепей (глобул), соединенных с четырьмя гемами.
.В каждом геме содержится один атом двухвалентного железа, который может непрочно связывать одну молекулу кислорода. В результате такого связывания образуется оксигемоглобин, одна молекула которого переносит к тканям четыре молекулы кислорода. Из тканей гемоглобин выносит углекислый газ, молекулы которого присоединяются к аминогруппам, содержащимся в полипептидных цепях.
Источник
Строение и свойства белков
Вопрос 1.
Белки – природные полимеры, мономерами которых являются аминокислоты (20 природных L – аминокислот). Белковые полимеры – это полипептидные цепи последовательно соединённых аминокислот – первичная структура. Молекула белка обычно содержит неполярные и полярные радикалы. Неполярные радикалы располагаются внутри молекулы, полярные ионогенные группы на поверхности молекулы, полярные неионогенные радикалы могут располагаться как на поверхности, так и внутри белковой молекулы. Все эти радикалы участвуют в закручивании полипептидной цепи при помощи водородных, сульфидных и ионных связей, а также электростатического притяжения — вторичная структура, а также они участвуют в образовании третичной структуры полипептида – сворачивании и изгибании полипептидной цепи. Водородные связи не участвуют в образовании третичной структуры белка.
Вопрос 2.
Пептид – полимер, содержащий небольшое число мономеров – аминокислот. Дипептиды, трипептиды имеют небольшую молярную массу, обычно до 500 г/моль.
Полипептид – полимер, мономерами которого являются аминокислоты, но, в отличие от пептида, содержит большое количество аминокислот. Молярная масса полипептида может достигать величины до 10000 г/моль.
Полиамид – полимер, молярная масса которого может быть 10000-30000 г/моль, мономерами являются аминокислоты.
Белки – полимеры, мономерами которых являются природные аминокислоты. Молярная масса белка обычно больше 30000 г/моль.
Вопрос 3.
Огромное разнообразие природных белков не даёт возможности сформировать их физические свойства. По своим физическим свойствам белки представляют собой твёрдые вещества, растворимые или нерастворимые в воде с различными температурами кипения и плавления.
Химические свойства белков:
1. Гидролиз – образуются аминокислоты.
2. Денатурация – процесс разрушения третичной и вторичной структур белка, который обычно протекает под действием кислот, щелочей, солей тяжёлых металлов при, нагревании, радиации, органических кислот и других факторов.
3. Горение – при сжигании белки обугливаются, и при этом появляется специфический запах жжёного пера (рога).
Вопрос 4.
Качественные реакции на белки:
а) ксантопротеиновая реакция – при действии концентрированной азотной кислоты на раствор белка выпадает ярко-жёлтый осадок.
б) биуретовая реакция – при действии раствора щёлочи в присутствии сульфата меди (II) на раствор белка появляется сине-фиолетовое окрашивание раствора.
Вопрос 5.
В организме человека белки играют важнейшую роль. Они выполняют следующие функции:
а) каталитическую (ферменты);
б) регуляторную (гормоны);
в) запасающую (резервные питательные вещества);
г) защитную (иммуноглобулины, интерфероны);
д) транспортную (гемоглобин);
е) двигательную (лигозин); строительную (коллаген).
Вопрос 6.
Иммунные свойства организмов определяют иммуноглобулин и интерферон.
Вопрос 7.
СПИД – синдром иммунодефицита, распространителем является вирус ВИЧ (вирус иммунодефицита человека), который, проникая в организм человека через кровь, разрушает клетки Т-лимфоцитов, которые обеспечивают сопротивляемость организма к различным заболеваниям, так как вырабатывают антитела. Но, заболев СПИДом, организм человека не способен противостоять многим смертельным заболеваниям, к которым у здорового человека вырабатываются противоядия (антитела). И умирают люди не от СПИДа как такового, а от других заболеваний, вируса Герпеса, саркомы, пневмонии и др.
Так как передаётся ВИЧ через кровь, половой контакт и плаценту, то профилактикой является:
1) использовать презервативы при половом контакте;
2) не вести беспорядочные половые связи;
3) пользоваться одноразовыми шприцами, иглами и т.п.;
4) больная мать не должна рожать детей.
Вопрос 8.
Если поджечь кусочек ткани из натурального волокна, то будет наблюдаться выделение специфического запаха жжёного пера (рога) и образование чёрной золы. Синтетическое волокно не горит, оно только плавится.
- Вы здесь:
- Главная
- Химия
- О.С. Габриелян-10кл
- Азотсодержащие соединения | Глава 5. Параграф 27
Источник
3. Основные биополимеры и их мономеры
Статическая биохимия выявила характерную черту живых клеток – их сложность и высокий уровень молекулярной организации, переход от простых компонентов клетки к более сложным. Структурную организацию живой клетки можно представить в виде следующей схемы.
(нуклеотиды, аминокислоты, моносахариды, жирные кислоты, глицерин)
(нуклеиновые кислоты, белки, полисахариды, липиды)
(нуклеопротеины, гликопротеины, липопротеины)
(рибосомы, ядрышко, мембраны)
(ядро, митохондрии, лизосомы)
4. Общая характеристика метаболических процессов
Метаболизм – совокупность биохимических реакций живого организма, предназначенных для обеспечения его жизнедеятельности.
В метаболизме можно выделить 2 компонента:
- пластический обмен – все реакции, приводящие к синтезу и распаду веществ;
- энергетический обмен – запасание и расход энергии. При этом клетки используют только энергию химических связей.
- катаболизм – расщепление крупных молекул с выделением энергии, заключенной в их структуре и запасание ее в форме АТФ;
- анаболизм – синтез крупных молекул из мелких, идущий с затратой энергии.
Раздел 2. Белковые вещества Лекция 2. Общая характеристика белков и аминокислот. Строение, классификация и свойства аминокислот
Белки – это высокомолекулярные азотсодержащие органические соеди-нения, состоящие из остатков аминокислот, соединенных пептидными связями. Иными словами белки – это полимеры, мономерами которых являются аминокислоты. Белки построены из сотен или тысяч аминокислотных остатков, соединенных пептидными связями. Разнообразие существующих в природе белков зависит от особенностей аминокислотного состава, количества аминокислотных остатков и порядка их сочетания.
1. Общая характеристика аминокислот
Всего в природе обнаружено около 300 аминокислот. По способности входить в состав белков аминокислоты бывают: 1) Протеиногенные (протеин – белок; генезис – дающий, рождающий). Количество белковых, или протеиногенных аминокислот, составляет относительно невелико: в живых организмах имеется 20 основных протеиногенных аминокислот. Помимо стандартных 20 аминокислот, в белках встречаются и модифицированные аминокислоты, которые являются производными обычных аминокислот. 2) Непротеиногенные (в состав белков не входят); бывают α, β и γ. Примеры:
- β-аланин (входит в состав витаминов В3);
- γ-аминомасляная кислота (участвует в передаче нервного импульса; участвует в цикле обезвреживания аммиака).
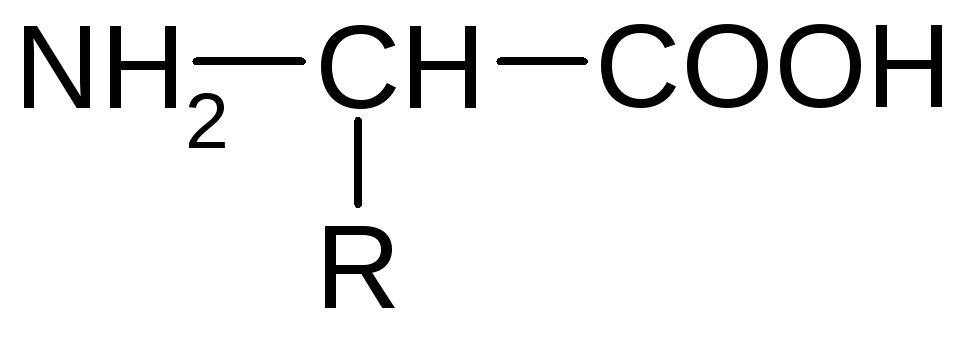
В виде очищенных препаратов белковые (протеиногенные) аминокислоты представляют собой белые кристаллические вещества: сладкие, горькие или не имеющие вкуса. Все белковые аминокислоты являются α-аминокислотами с характерной общей структурной особенностью: наличием карбоксильной и аминной групп, связанных с атомом углерода в α-положении. Помимо карбоксильной и аминогрупп, каждая аминокислота имеет радикал, который у разных аминокислот неодинаков по структуре, электрическому заряду и растворимости.
Источник