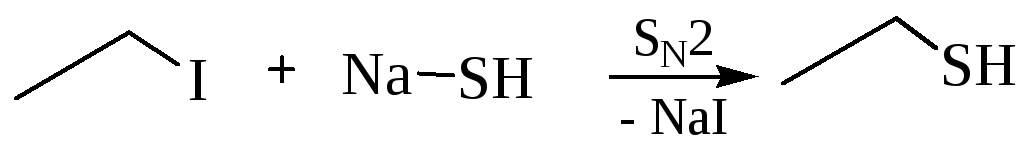ТИОЛЫ
ТИОЛЫ (меркаптаны, тиоспирты), содержат в молекуле меркаптогруппу —SH (сульфгидрильную группу), непосредственно связанную с орг. радикалом. В статье рассмотрены алифатические и алициклические тиолы, об ароматических тиолах см. Тиофенолы.
Атом S в меркаптогруппе имеет гибридизацию, промежуточную между sp 2 и sp 3 ; длины связей, напр., для СН 3 SН(нм) 0,1817 (С—S), 0,1329 (S—H), угол CSH 96,5°. Энергия связи S—H 360 кДж/моль. Группа SH обладает слабым отрицат. индукционным и положит. мезомерным эффектами; константы Гаммета s мета 0,25, s h a r a 0,15. Кислотные св-ва ее выше, а основные ниже, чем группы ОН.
Названия тиолов производят прибавлением к названию соответствующего углеводорода суффикса «тиол», напр. СН 3 SН-метантиол, С 6 Н 11 SН -циклогексантиол.
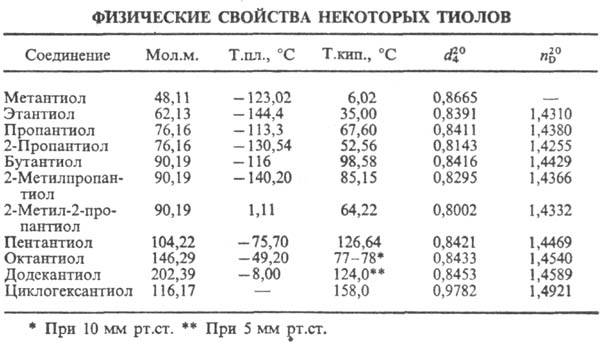
Низшие алифатические тиолы обладают резким неприятным запахом, к-рый обнаруживается при очень низких концентрациях (до 2·10 -9 мг/л). Тиолы кипят при более низких т-рах, чем их кислородные аналоги, что обусловлено меньшей склонностью к самоассоциации (см. табл.).
В разб. р-рах тиолы существуют в виде мономеров, а в более концентрированных-в виде димеров преим. линейного строения благодаря образованию водородных связей S—H. S; в жидком и твердом состоянии могут образовывать полимеры.
Для тиолов характерна линейная зависимость термодинамич. величин от мол. массы. Энергия диссоциации связи С—SH в тиолах для: CH 3 SH 293,3; C 2 H 5 SH 289,1; C 3 H 7 SH 284,9; mpem-C 4 H 9 SH 272,35 кДж/моль. Для CH 3 SH потенциал ионизации 9,44 эВ, с удлинением цепи понижается. В ИК спектрах тиолов присутствует характеристич. полоса 2572 см -1 , соответствующая валентным колебаниям группы SH; в спектрах комбинац. рассеяния характеристич. частоты 703, 1428 и 2572 см -1 . В спектре ПМР хим. сдвиг ( d ) протона группы SH 1-2 м.д.; электроноакцепторные заместители смещают сигнал в более слабое поле.
Т иолы-слабые к-ты, рК а 10-11 (25 °С, вода), кислотность с удлинением и разветвлением алифатич. цепи понижается, при введении электроноакцепторных заместителей повышается. Для замещенных метантиолов RCH 2 SH значения рК а коррелируют с индукц. константами Тафта s *: рК а = = 10,22 — 3,50 s *.
Хим. св-ва тиолов определяются наличием подвижного атома водорода и неподеленных пар электронов у атома S. Для тиолов характерна высокая нуклеофильность в сочетании с относительно низкой основностью. В качестве нуклеофилов тиолы замещают атомы или группы у насьпц. атома углерода, присоединяются к алкенам и алкинам.
Т иолы легко окисляются. При действии О 2 в щелочной среде, иода, o-иодбензойной к-ты, алифатич. сульфоксидов, акти-вир. МnО 2 , Н 2 О 2 и N 2 О 4 образуются дисульфиды RSSR (в присут. металлов-Сu, Со, Ni-p-ция протекает по радикальному механизму); (СН 3 СОО) 4 Рb в спирте окисляет тиолы до сульфинатов RSOOCH 3 , галогены в водной среде-до сульфонилгалогенидов RSO 2 Hal, НКО 3 -до сульфокислот RSO 3 H.
В газовой фазе при 400 °С тиолы разлагаются на H 2 S и соответствующий олефин.
Гетеролитич. присоединение тиолов к активир. олефинам идет обычно в присут. оснований и протекает против правила Марковникова, для 1,1-диалкилэтиленов оно идет в присут. к-т и по правилу Марковникова, напр.:
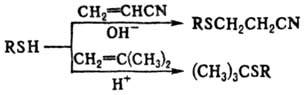
Против правила Марковникова присоединяются к олефинам также тиильные радикалы, генерируемые из тиолов под действием УФ облучения, в присут. пероксидов, диазосоед. и др.
Замещенные ацетилена реагируют с тиолами либо по правилу Марковникова, либо против него, напр.:
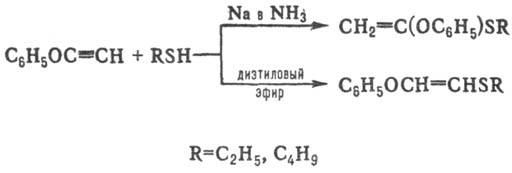
Р-ция тиолов с ацетиленами стереоспецифична.
Взаимодействие тиолов с нитрилами в кислых средах приводит к иминотиоэфирам, напр.:
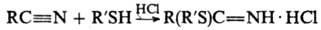
При действии тиолов на альдегиды или кетоны в присут. кислых катализаторов образуются соответствующие тио-ацетали или тиокетали:
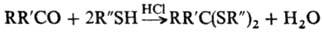
Мн. р-ции тиолов протекают по ионному механизму с участием тиолат-анионов, обладающих сильными нуклеоф. св-вами. Тиолат-анионы генерируются из тиолов в р-рах NaOH, триэтаноламина, пиридина и др., а также образуются при взаимод. эфиров тиолов (напр., CH 3 COSR) с сильными основаниями в неводных средах либо при гидролизе тиомочевины.
Тиолат-анионы легко замещают атомы галогена (обычно Сl) в галогенидах В, Si, Sn, Ge, P, Мо и др., напр.:
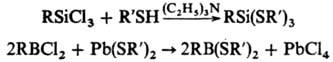
Р-ции тиолат-анионов с алкилхлоридами протекают в жидком NH 3 , с гексахлор- и гексафторбензолом — в среде этиленгликоля или пиридина (гексабромбензол с тиолат-анионами не реагирует), напр.:
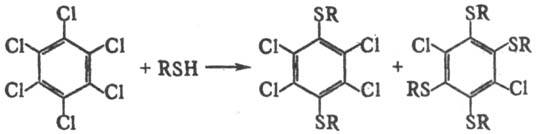
В основных или нейтральных средах тиолы расщепляют оксирановые или тиирановые циклы, напр.:
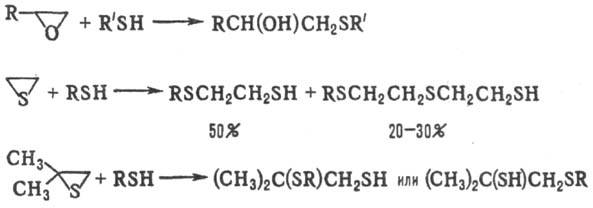
Ацилирование тиолов в присут. оснований приводит к S-ациль-ным производным, напр.:
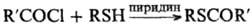
При обработке тиолов нитрозирующими агентами (NOC1, HNO 2 ) образуются неустойчивые тионитриты RSNO, обладающие характерной окраской (цветная проба на тиолы).
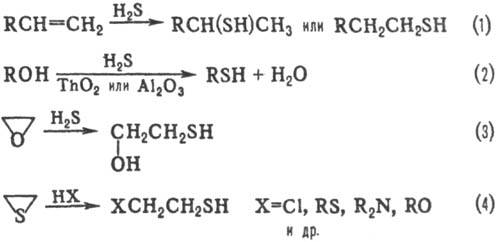
Осн. методы синтеза: 1) взаимод. NaSH или KSH с алкилирующими агентами [RI, ROSO 3 H, (RO) 2 SO 2 и др.]. 2) Присоединение H 2 S к алкенам (ур-ние 1); в присут. катализаторов (металлы, оксиды или сульфиды металлов, к-ты, S) р-ция протекает по правилу Марковникова, при УФ облучении-против правила. 3) Пропускание паров спирта и H 2 S над ТhO 2 или Аl 2 О 3 (2); тиолы образуются также при взаимод. спиртов (обычно C 4 -C 16 ) с P 4 S 10 (выход выше 70%). 4) Для получения b -замещенных тиолов используют расщепление оксиранового цикла (или этиленимина) H 2 S (3) либо тииранового цикла разл. агентами (4).
Т иолы могут быть получены также р-цией тиолкарбоновых к-т с алкенами или алкилгалогенидами с послед. гидролизом образующихся тиоэфиров (5); конденсацией алкилгалогени дов с тиомочевиной и далее щелочным гидролизом изо-тиурониевой соли (6) либо конденсацией алкилгалогени-дов с Na 2 S 2 O 3 и кислотным гидролизом S-алкилтиосуль-фатов (т. наз. солей Бунте; см. Тиосульфаты органические) (7).
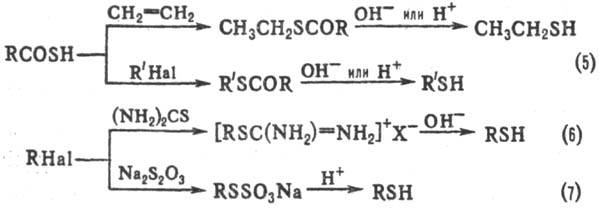
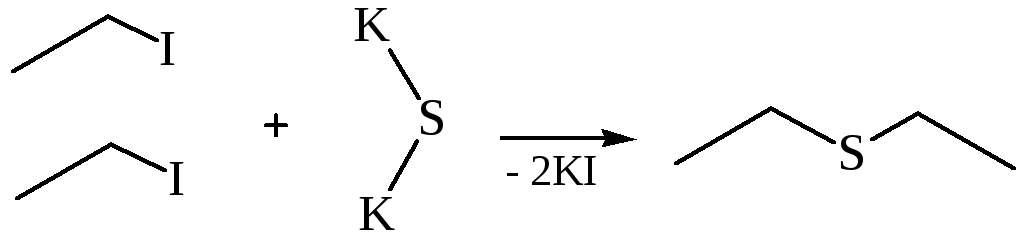
Др. методы получения: взаимод. алкилгалогенидов с ксантогенатами щелочных металлов с послед. щелочным гидролизом или восстановлением LiAlH 4 образующихся алкил-ксантогенатов (ур-ние 8), кислотный гидролиз или восстановление тритиокарбонатов (9); щелочной гидролиз дитио-карбаматов, получаемых взаимод. алкилхлоридов с N , N -диметилдитиокарбаматом Na (10); восстановление тионов, получаемых из кетонов и P 4 S 10 ; восстановление диалкил-дисульфидов LiAlH 4 , NaBH 4 , Zn-Hg в H 2 SO 4 , PPh 3 в CH 3 OH.
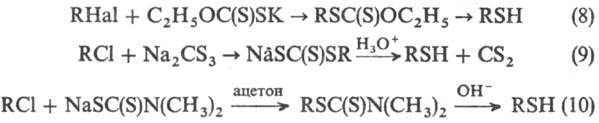
В пром-сти низшие тиолы получают взаимод. спиртов с H 2 S в присут. катализаторов при 300-350 °С; трет-алкантиолы C 8 -C 16 -взаимод. непредельных углеводородов с H 2 S в присут. А1 2 О 3 при 100-135 °С и давлении 3,5-7 МПа. С 1982 начато пром. выделение низших тиолов из высокосернистого прир. газа.
Низшие тиолы (С 2 -С 3 ) используют в качестве одорантов топливных газов, для получения пестицидов (напр., пер-хлорметилмеркаптан CCl 3 SCl); метантиол-для произ-ва метионина; тиолы C 8 -C 16 -регуляторы полимеризации в произ-ве латексов, каучуков.
Тиолы, являющиеся ловушками для радикалов, используют для защиты от радиации и как антиокислители, напр. додекантиол—стабилизирующая добавка для каучуков.
Мировое произ-во тиолов 200 тыс. т/год (1986), из них CH 3 SH более 20 тыс. т/год, тиолов С 2 -С 8 и выше-более 100 тыс. т/год.
Лит.: Прилежаева E. H., Шостаковский М, F ., «Успехи химии», 1963, т. 32, в. 8, с. 897-947; Общая органическая химия, пер. с англ., т. 5, М., 1983, с. 130-51; Большаков Г. Ф., Сераорганические соединения нефти, Новосиб., 1986; Houben-Weyl, Methoden der organischen Chemie, Bd 9, Stuttg., 1955; The chemistry of the Tiol Group, ed. by S. Patai, N. Y., 1974. Э. H. Дерягина.
Источник
3.5 Тиолы
Тиолы (меркаптаны,тиоспирты), содержат вмолекулемеркаптогруппу –SH (сульфогидрильную группу), непосредственно связанную с органическим радикалом. Тиолы можно рассматривать как производные сероводорода, в котором один атом водорода замещен углеводородным остатком, которые являются аналогами алканолов, алкенолов и фенолов.
Номенклатура тиолов подобна номенклатуре гидроксилпроизводных, только вместо суффикса -ол применяется -тиол или вместо префикса гидрокси- (окси-) применяется меркапто-. Иногда эти соединения называют меркаптанами, тиоспиртами, тиофенолами. Номенклатура ИЮПАК использование этих названий не рекомендует. Названия тиолов производят прибавлением к названию соответствующего углеводородасуффикса-тиол, (таблица 16).
Таблица 16 – Название тиолов
Cистематическая
Радикально-функциональная
СН3СН2SН
СН3СН2СН2SН
1. Из тиолкарбоновых кислот. Тиолы могут быть получены реакцией тиолкарбоновых кислот с алкенамиили алкилгалогенидами с последующимгидролизомобразующихсятиоэфиров:
2. Конденсация алкилгалогенидов с тиомочевиной и последующим щелочным гидролизомизотиурониевойсолилибоконденсацияалкилгалогенидов сNa2S2O3 и кислотным гидролизомS-алкилтиосульфатов:
3. Реакции нуклеофильного замещения
3.1 Алкилирование гидросульфата:
3.2 Алкилирование сероводорода:
3.3 Получение тиоэфиров:
4. Взаимодействие алкилгалогенидов с ксантогенатамищелочных металлов (Л.А. Чугаев):
5. Промышленные методы. В промышленности низшие тиолы получают взаимодействием спиртовсH2S в присутствии катализаторовпри 300–350 °С. Третичные алкантиолыC8 – C16 – взаимодействием непредельных углеводородовсH2S в присутствии А12О3 при 100–135 °С и давлении3,5–7 МПа.
Физические свойства и строение. Тиолы представляют собой бесцветные соединения с чрезвычайно неприятным запахом, которым обнаруживается уже в ничтожных концентрациях. Алкантиолы содержатся в кишечных газах человека и животных, в зловонных выделениях некоторых животных.
АтомS в меркаптогруппе имеет гибридизацию, промежуточную междуsp 2 и sp 3 . Например, для молекулы СН3SН:
- длины связей С–S 0,1817 нм, S–H 0,1329 нм;
- валентный угол CSH = 96,5°;
- энергия связи S–H 360 кДж/моль.
Потенциал ионизациидляCH3SH – 9,44 эВ с удлинением углеродной цепи понижается. Электронная система атома серы значительно подвижнее, чем кислоррода, что отражается и на энергии ионизации. Тиолы являются более сильными электронодонорами. В молекулах тиолов угол CSH равен 100–104°, что меньше, чем угол СОН в алканолах. Для тиолов характерна линейная зависимость термодинамических величин от молекулярной массы (таблица 17). Таблица 17 – Энергия диссоциациисвязиС–SH в тиолах
| Соединение | Eдис.,кДж/моль |
| CH3SH | 293,3 |
| C2H5SH | 289,1 |
| C3H7SH | 284,9 |
| C4H9SH | 272,35 |
Группа SH обладает слабым –I и +M эффектами, кислотные свойства ее выше, а основные ниже, чем группыОН. Связь S–Н менее полярна, чем связь О–Н, поэтому у тиолов слабее межмолекулярные водородные связи и ниже температуры кипения, чем у соответствующих кислородных аналогов (таблица 18). Таблица 18 – Физические свойства некоторых тиолов
| Соединение | Мr | Тпл.,°С | Ткип.,°С | d420 | nD20 |
| Метантиол | 48.11 | –123,02 | 6,02 | 0,8665 | – |
| Этантиол | 62,13 | –144,40 | 35,00 | 0,8391 | 1,4310 |
| Пропантиол | 76.16 | –113,30 | 67,60 | 0,8411 | 1,4380 |
| 2—Пропантиол | 76,16 | –130,54 | 52,56 | 0,8143 | 1.4255 |
| Бутантиол | 90,19 | –116,00 | 98,58 | 0,8416 | 1,4429 |
| 2—Метилпропантиол | 90,19 | –140,20 | 85,15 | 0,8295 | 1,4366 |
| Пентантиол | 104,22 | –75,70 | 126,64 | 0,8421 | 1,4469 |
| Циклогексантиол | 116,17 | – | 158,0 | 0,9782 | 1,4921 |
| Октантиол | 146,29 | –49,20 | 77–78 | 0,8433 | 1,4540 |
| 2—Метил—2—пропантиол | 90,19 | 1,11 | 64,22 | 0.8002 | 1,4332 |
В разбавленных растворах тиолы существуют в виде мономеров, а в более концентрированных – в виде димеров преимущественно линейного строения благодаря образованию водородных связейS–H. S. В жидком и твердом состоянии тиолы могут образовывать полимеры. Химические свойства1. Кислотные свойства. Тиолы более сильные кислоты, чем соответствующие спирты (рК этантиола –10,5, а этанола –18). Легкая поляризуемость атома серы, вследствие большего атомного радиуса и меньшей электроотрицательностью по сравнению с атомом кислорода, способствует делокализации отрицательного заряда, образующегося алкилсульфид-иона RS – и, следовательно, повышает его стабильность. 

Источник