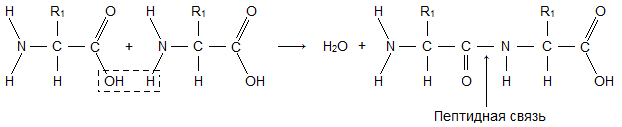Нарушение природной структуры белка называют
Органические вещества – важные и необходимые компоненты клетки, они являются поставщиками энергии, без которой невозможно проявление любой формы жизнедеятельности; они образуют структуры клетки.
Белки — полимеры аминокислот.
Существует 20 независимых аминокислот, входящих в белки.
Белки — обязательная составная часть всех клеток. В жизни всех организмов белки имеют первостепенное значение. В состав белка входят углерод, водород, азот, некоторые белки содержат еще и серу. Роль мономеров в белках играют аминокислоты. У каждой аминокислоты имеется карбоксильная группа (-СООН) и аминогруппа (-NH2). Наличие в одной молекуле кислотной и основной групп обусловливает их высокую реактивность. Между соединившимися аминокислотами возникает связь называемая пептидной, а образовавшееся соединение нескольких аминокислот называют пептидом. Соединение из большого числа аминокислот называют полипептидом. В белках встречаются 20 аминокислот, отличающихся друг от друга своим строением. Разные белки образуются в результате соединения аминокислот в разной последовательности. Огромное разнообразие живых существ в значительной степени определяется различиями в составе имеющихся у них белков.
В строении молекул белков различают четыре уровня организации:
Первичная структура — полипептидная цепь из аминокислот, связанных в определенной последовательности ковалентными (прочными) пептидными связями.
Вторичная структура — полипептидная цепь, закрученная в виде спирали. В ней между соседними витками возникают мало прочные водородные связи. В комплексе они обеспечивают довольно прочную структуру.
Третичная структура представляет собой причудливую, но для каждого белка специфическую конфигурацию — глобулу. Она удерживается мало прочными гидрофобными связями или силами сцепления между неполярными радикалами, которые встречаются у многих аминокислот. Благодаря их многочисленности они обеспечивают достаточную устойчивость белковой макромолекулы и ее подвижность. Третичная структура белков поддерживается также ковалентными S-S-связями возникающими между удаленными друг от друга радикалами серосодержащей аминокислоты — цистеина.
Благодаря соединению нескольких молекул белков между собой образуется четвертичная структура. Если пептидные цепи уложены в виде клубка, то такие белки называются глобулярными. Если полипептидные цепи уложены в пучки нитей, они носят название фибриллярных белков.
Нарушение природной структуры белка называют денатурацией. Она может возникать под действием высокой температуры, химических веществ, радиации и т.д. Денатурация может быть обратимой (частичное нарушение четвертичной структуры) и необратимой (разрушение всех структур).
1. каталитическая (ферментативная) — расщепление питательных веществ в пищеварительном тракте, фиксация углерода при фотосинтезе, участие в реакциях матричного синтеза;
2. транспортная — транспорт ионов через клеточные мембраны, транспорт кислорода и углекислого газа гемоглобином, транспорт жирных кислот сывороточным альбумином;
3. защитная — антитела, обеспечивающие иммунную защиту организма; фибриноген и фибрин защищают организм от кровопотерь;
4. структурная — кератин волос и ногтей, коллаген хрящей, сухожилий, соединительных тканей;
5. сократительная— сократимые белки мышц: актин и миозин;
6. рецепторная — примером могут служить фитохром — светочувствительный белок, регулирующий фотопериодическую реакцию в растениях, и опсин — составная часть родопсина — пигмента, находящегося в клетках сетчатки глаза.
Источник
§ 4. Свойства и функции белков
Молекулы простых белков построены только из аминокислотных остатков. В состав сложных белков, кроме того, входит какой-либо компонент неаминокислотной природы.
Фибриллярными называют белки, молекулы которых имеют вытянутую, нитевидную форму (коллаген, кератин, миозин). Молекулы глобулярных белков имеют округлую форму (альбумины и глобулины крови, гемоглобин).
2. Как называется процесс нарушения природной структуры белка, при котором сохраняется его первичная структура? Действие каких факторов может приводить к нарушению структуры белковых молекул?
Процесс нарушения природной структуры белка, при котором сохраняется его первичная структура, называется денатурацией.
Действие высоких и низких температур, сильных кислот и щелочей, ионов тяжелых металлов, ультрафиолетового излучения, радиации может приводить к нарушению структуры белковых молекул.
3. Назовите основные биологические функции белков, приведите соответствующие примеры.
| Биологические функции белков | Примеры |
| Каталитическая (ферментативная) | Пищеварительные ферменты липазы ускоряют расщепление липидов, амилаза и мальтаза — углеводов, пепсин и трипсин — белков. |
| Структурная | Кератин — основной компонент волос, ногтей, когтей, копыт, рогов, перьев. Эластин входит в состав стенок артерий, связок и др., коллаген — в состав кожи, сухожилий, костной, хрящевой и других тканей. |
| Транспортная | Дыхательный пигмент гемоглобин переносит кислород и углекислый газ в крови позвоночных животных, а у многих моллюсков и ряда членистоногих эту функцию выполняет гемоцианин. |
| Сократительная (двигательная) | Белки актин и миозин обеспечивают сократимость гладкой и поперечнополосатой мышечных тканей. |
| Регуляторная | Гормоны инсулин и глюкагон регулируют уровень глюкозы в крови. Процессы роста и физического развития человека протекают под контролем гормона соматотропина. |
| Сигнальная (рецепторная) | Зрительные пигменты глаза — родопсин (содержится в палочках) и йодопсины (в колбочках) — обеспечивают восприятие света фоторецепторными клетками, их возбуждение и запуск нервного импульса. |
| Защитная | Тромбопластин, тромбин и фибриноген обеспечивают свертывание крови, защищая организм от кровопотери. Иммуноглобулины (антитела) участвуют в иммунном ответе организма на чужеродные объекты — антигены. Лизоцим, содержащийся в слюне, слезной жидкости и др., обладает антибактериальными свойствами. |
| Токсическая | Токсины, выделяемые многими бактериями (дифтерийный, ботулиновый, столбнячный, холерный и др.), по химической природе являются белками. Действующие вещества в составе ядов змей, некоторых пауков, скорпионов и насекомых также представляют собой белки. |
| Запасающая | Резервные белки, которые откладываются в семенах растений. Миоглобин играет важную роль в создании кислородного запаса в мышечных волокнах. |
| Энергетическая | При полном окислении 1 г белка выделяется 17,6 кДж энергии. |
4. Что представляют собой ферменты? Опишите механизм работы фермента.
Ферменты — это белки, которые выполняют функции биологических катализаторов, т. е. ускоряют протекание химических реакций в живых организмах.
Ферменты ускоряют химические реакции за счет тесного взаимодействия с молекулами субстратов — исходных реагирующих веществ. С субстратом (или субстратами) взаимодействует не вся молекула фермента, а лишь небольшой ее участок — активный центр. Чаще всего он образован несколькими аминокислотными остатками. Активный центр каждого фермента имеет особую форму и химическое строение, поэтому с ним
могут связываться лишь определенные субстраты. Присоединение субстрата вызывает небольшие изменения конфигурации активного центра — такие, чтобы максимально соответствовать субстрату. Функционально активные группы фермента, за счет которых будет протекать реакция, наиболее благоприятным образом располагаются в пространстве. В результате присоединения к активному центру молекула субстрата
особым образом располагается в пространстве, и в ее структуре ослабляются определенные химические связи. Реакционная способность субстрата возрастает. Образовавшиеся продукты отделяются от активного центра. После этого он может принимать новые молекулы субстрата.
5. В чем заключается специфичность ферментов? Какова ее причина? Почему ферменты активно функционируют лишь в определенном диапазоне температуры, рН и других факторов?
Специфичность ферментов заключается в том, что каждый фермент ускоряет только одну определенную реакцию или действует только на один тип связи. Причиной является соответствие активного центра фермента определенным субстратам.
Ферменты являются белками, поэтому активно работают лишь в определенном диапазоне температуры, рН и других факторов.
6. Почему белки, как правило, используются в качестве источников энергии лишь в крайних случаях, когда в клетках исчерпаны запасы углеводов и жиров?
Потому что белки выполняют очень важные биологические функции, многие из которых не могут выполнять ни углеводы, ни жиры. К тому же, при полном расщеплении белков образуются не только СО2 и Н2О (в отличие от углеводов и жиров), но и соединения азота и серы, причём некоторые из них токсичны для организма.
7. У многих бактерий в процессах синтеза веществ, необходимых для нормальной жизнедеятельности и размножения, участвует парааминобензойная кислота (ПАБК). В то же время в медицине для лечения ряда бактериальных инфекций используются сульфаниламиды — вещества, по структуре сходные с ПАБК. Как вы думаете, на чем основано лечебное действие сульфаниламидов?
С помощью фермента бактерии превращают ПАБК в продукт, который затем используется для синтеза необходимых ростовых факторов.
Из-за структурного сходства с ПАБК, сульфаниламиды также способны связываться с активным центром этого фермента, блокируя его работу. Это приводит к нарушению синтеза ростовых факторов и нуклеиновых кислот у бактерий.
Присоединяйтесь к Telegram-группе @superresheba_11, делитесь своими решениями и пользуйтесь материалами, которые присылают другие участники группы!
Источник
Строение белков
Среди органических веществ белки, или протеины, — самые многочисленные, наиболее разнообразные и имеющие первостепенное значение биополимеры. На их долю приходится 50 — 80% сухой массы клетки.
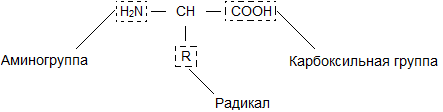
Молекулы белков имеют большие размеры, поэтому их называют макромолекулами. Кроме углерода, кислорода, водорода и азота, в состав белков могут входить сера, фосфор и железо. Белки отличаются друг от друга числом (от ста до нескольких тысяч), составом и последовательностью мономеров. Мономерами белков являются аминокислоты (рис. 1)
Бесконечное разнообразие белков создается за счет различного сочетания всего 20 аминокислот. Каждая аминокислота имеет свое название, особое строение и свойства. Их общую формулу можно представить в следующем виде:
Молекула аминокислоты состоит из двух одинаковых для всех аминокислот частей, одна из которых является аминогруппой (—NH2) с основными свойствами, другая — карбоксильной группой (—COOH) с кислотными свойствами. Часть молекулы, называемая радикалом (R), у разных аминокислот имеет различное строение. Наличие в одной молекуле аминокислоты основной и кислотной групп обусловливает их высокую реакционную способность. через эти группы происходит соединение аминокислот при образовании белка. При этом возникает молекула воды, а освободившиеся электроны образуют пептидную связь. Поэтому белки называют полипептидами.
Молекулы белков могут иметь различные пространственные конфигурации, и в их строении различают четыре уровня структурной организации.
Последовательность аминокислот в составе полипептидной цепи представляет первичную структуру белка. Она уникальна для любого белка и определяет его форму, свойства и функции.
Большинство белков имеют вид спирали в результате образования водородных связей между —CO- и —NH- группами разных аминокислотных остатков полипептидной цепи. Водородные связи малопрочные, но в комплексе они обеспечивают довольно прочную структуру. Эта спираль — вторичная структура белка.
Третичная структура — трехмерная пространственная «упаковка» полипептидной цепи. В результате возникает причудливая, но для каждого белка специфическая конфигурация — глобула. Прочность третичной структуры обеспечивается разнообразными связями, возникающими между радикалами аминокислот.
Четвертичная структура характерна не для всех белков. Она возникает в результате соединения нескольких макромолекул с третичной структурой в сложный комплекс. Например, гемоглобин крови человека представляет комплекс из четырех макромолекул белка.
Такая сложность структуры белковых молекул связана с разнообразием функций, свойственных этим биополимерам.
Нарушение природной структуры белка называют денатурацией. Она может происходить под воздействием температуры, химических веществ, лучистой энергии и других факторов. При слабом воздействии распадается только четвертичная структура, при более сильном — третичная, а затем — вторичная, и белок остается в виде полипептидной цепи.
Этот процесс частично обратим: если не нарушена первичная структура, то денатурированный белок способен восстанавливать свою структуру. Отсюда следует, что все особенность строение макромолекулы белка определяются его первичной структурой.
Кроме простых белков, состоящих только из аминокислот, есть еще и сложные белки
Источник