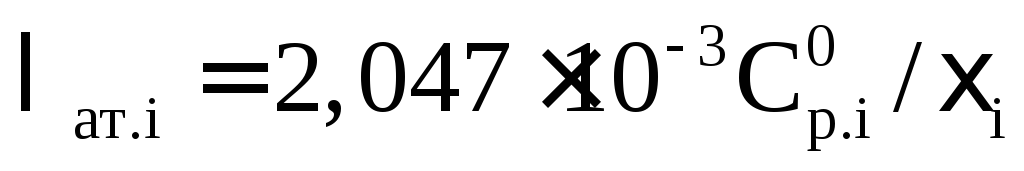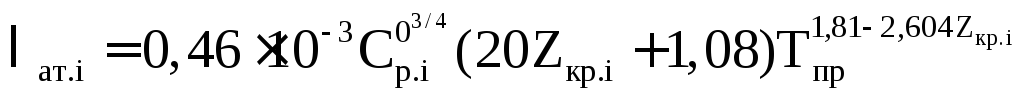Свойства природных газов и лёгких углеводородных жидкостей
Знание свойств и поведения природного газа, будь то чистый метан или смесь легких углеводородов (часто с добавками неуглеводородных газов — азота, углекислоты и сероводорода), позволяет более рационально решать вопросы его добычи, переработки н транспорта. Компоненты природного газа обычно находятся в газообразном состоянии, но иногда могут существовать как жидкости или твердые тела. Наиболее важным является вопрос о фазовом состоянии, в котором находятся компоненты природного газа. В этой главе будут рассмотрены следующие свойства природных газов и их компонентов;
коэффициент диффузии; коэффициент сжимаемости газов; плотность газов и жидкостей; поверхностное натяжение; термодинамические свойства:
б) скрытая теплота парообразования,
в) энтальпия смеси; теплотворная способность; пределы воспламеняемости; критические свойства; вязкость;
Состав природных газов некоторых месторождений приведен в табл. I. 5 и I. 8. Методы анализа газов приведены в главе VI в связи с рассмотрением равновесия системы жидкость — пар. В общем по своему составу природные газы сходны между собой. Для большинства газов концентрации компонентов изменяются в довольно узких пределах. Использование удельного веса газа в качестве характеризующего параметра зависит от того, насколько газы сходны по составу. Легатский, Тук и Гранди (Legatski, Tooke and Grundy) [VI. 57] дали диаграмму, на которой состав любого газа выражается прямой линией (рис. IV. I).
Физические свойства чистых углеводородов даны В табл. П. I (см. приложение).
§ 1. МОЛЕКУЛЯРНАЯ ТЕОРИЯ ГАЗОВ И ЖИДКОСТЕЙ
Свойства газов и жидкостей обусловлены природой молекул и сил межмолекулярного взаимодействия. Кинетическая теория газов, разработанная в XIX в. Джоулем, Клаузиусом, Больцманом и Максвеллом, трактует газовое состояние как «совокупность молекул, каждая из которых движется в произвольном направлении, при* чем движение одной молекулы совершенно не контролируется силами других молекул, несмотря на то, что как скорость, так и направление ее движения могут резко меняться всякий раз, когда она сталкивается с другой молекулой или ударяется о стенки сосуда» [IV. 45]. В первом приближении газ можно рассматривать как совокупность частиц, не имеющих объема и не взаимодействующих между собой. Поведение газов при низких давлениях согласуется с теорией, основанной на этих простых предположениях. Постепенно, по мере накопления данных о несоответствии между теорией и наблюдаемым поведением реальных газов, это предположение видоизменялось. При этом более точно учитывался объем молекул и сил межмолекулярного взаимодействия. Позднее современная механико-статистическая теория, развитая на основе квантовой теории молекул, установила связь между всей совокупностью свойств газов и сил межмолекулярного взаимодействия [IV. 41].
Чтобы связать количество одного вещества с количеством другого, в теории материи было использовано понятие моля. Масса одного атома кислорода была произвольно принята за 16 (моль кислорода Ог за 32), а относительная масса других элементов или молекул была определена как их атомные или молекулярные веса. Закон Авогардо устанавливает, что равные объемы различных газов при одинаковой температуре и одинаковом давлении содержат одинаковое число молекул. Это число равно 6,02ХЮ 23 молекул в 1 г-моль вещества (32 г кислорода) при 0° С и атмосферном давлении (22 414 см 3 ). I кг-моль кислорода весит 32 ООО г и состоит из 1000X6,02ХЮ 23 = 6.02ХЮ 26 молекул.
Существуют два обычно применяемых метода приведения уравнения состояния идеальных газов (IV. 1) к виду, удобному для определения pVT (соотношений реальных газов). Один из них состоит в том, что в уравнение состояния идеальных газов вводится коэффициент сжимаемости г:
Этот газовый закон является общим для любнх газов. Коэффициент сжимаемости является функцией температуры, давления и состава газа и выражается в зависимости от этих переменных графически или аналитически.
Метод определения коэффициента сжимаемости по графикам будет детально изложен в соответствующем разделе ‘. Необходимо отметить, что в технических расчетах используется обычно именно этот метод для определения коэффициента сжимаемости газа.
Другой метод реальных соотношений газов заключается в применении уравнения состояния, учитывающего собственный объем молекул и силы молекулярного взаимодействия. Такое уравнение состояния реальных газов впервые было дано Ван-дер-Ваальсом в виде
где р — давление; V — объем; п — число молей; R — газовая постоянная; Т—абсолютная температура. Значение газовой постоянной R при различных размерностях давления, температуры и объема приведено в табл. IV. 1. При давлении, близком к атмосферному, поведение газов подчиняется законам идеального газа, так что давление или объем системы могут быть подсчитаны по данным значениям температуры и массы. При этом относительная ошибка будет составлять не более 5%. В тех случаях, когда требуется более точный подсчет или если газ находится при высоком давлении, уравнение идеального газа неприменимо.
Таблица IV. I Константы газового закона pV = nRT
Значения R для различных размерностей
Размерность давления р
Размерность объема V
Источник
2.2.9 Теплопроводность газа (рис 82-87)
Теплопроводность газа – это количество тепла, проходящего через его массы без перемещения, конвекции и теплообмена. Количество передаваемого тепла в газовой среде пропорционально градиенту температуры Δt, площади передачи F, продолжительности процесса теплопередачи τ, толщины слоя газа ΔL и выражается формулой:
где Δt=t2–t1 – разность температуры по обе стороны газовой среды толщиной ΔL; λ – коэффициент пропорциональности между количеством тепла и параметрами газовой среды.
Количество тепла, проходящего через единицы площади и толщины за единицы времени при разности температур, равной 1 град, принято называть коэффициентом теплопроводности. Коэффициент теплопроводности измеряется в Дж/м·с·град или Вт/м·град.
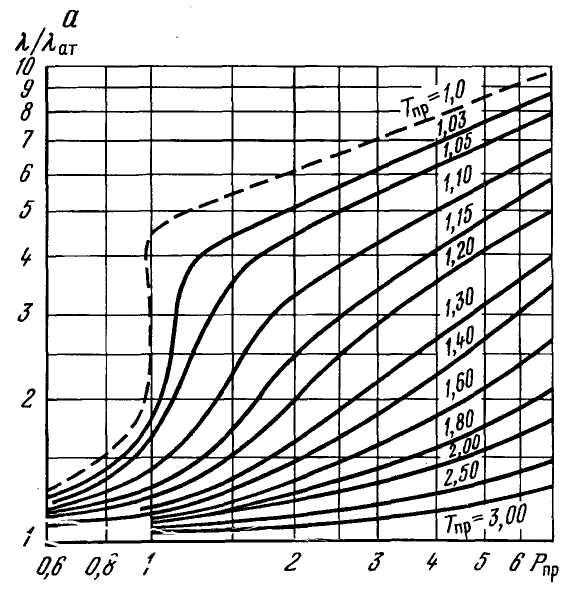
Теплопроводность газов зависит от давления, температуры и состава газа и определяется графическим или аналитическим методами. Все аналитические выражения для определения коэффициента теплопроводности получены аппроксимацией экспериментальных кривых. Наиболее простым способом определение λ является использование графических зависимостей λ/λат и λ/λкр от приведенных давления и температуры, показанных на рисунках 2.26 и 2.27, или зависимости (λ–λат) от приведенной плотности ρпр, показанной на рисунке 2.28. Для определения λ с использованием рисунка 2.27 необходимо вычислить величину λкр, т.е. теплопроводность газа при критических Ркр и Tкр.
Рисунок 2.26 – Зависимость приведенной теплопроводности λ/λат газов от приведенных давления и температуры – 0,6≤Рпр≤6 (a) и 0,1≤Рпр≤1 (б).
Для газовых смесей λкр должна быть определена как псевдокритическая теплопроводность по формуле:
где Мсм – молекулярная масса смеси, определяемая по формуле:
(2.68)
где Рп.кр и Тп.кр – псевдокритическое давление и температура.
Рисунок 2.27 – Зависимость приведенной теплопроводности λ/λкр газов от приведенных давления и температуры.
Рисунок 2.28 – Зависимость Δλ=λ–λат от приведенной плотности газов
При использовании рисунков 2.26 и 2.28 для определения λ необходимо вычислить величину λат, т.е. коэффициент теплопроводности при заданной температуре и атмосферном давлении Рат=0,098 МПа. Величину λат.см можно определить несколькими расчетными методами.
С погрешностью до 5% значение λат.см может быть определено по формуле:
(2.69)
Величина λат.i в формуле (2.69) определяется в зависимости от заданных температурных условий и состава газа из рисунка 2.29, по табличным данным или расчетным путем. В частности:
– для метана, нафтеновых и ароматических углеводородов при Тпр
; (2.70)
– для остальных углеводородов при любых температурах
(2.71)
– для неуглеводородных компонентов при Тпр
(2.72)
- для неуглеводородных компонентов при 1≤Тпр≤3
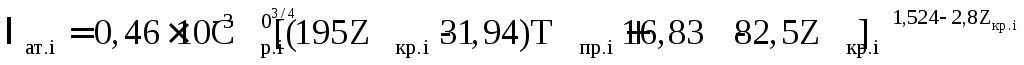
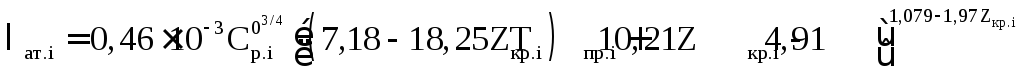




Источник
Коэффициент теплопроводности газа
Теория теплопередачи выделяет три вида передачи тепла в пространстве (или теплообмена):
Теплопроводность – это молекулярный процесс, который характеризуется передачей тепла при непосредственном соприкосновении тел с разницей температур за счёт обмена энергией движения структурных частиц.
Конвекция – это движение в пространстве частей среды с разницей температур, причём за счёт переноса самой среды.
Термоизлучение – это теплообмен посредством электромагнитного излучения.
Часто наблюдается совместное протекание всех процессов вместе.
Способность вещества проводить тепло зависит от интенсивности теплового движения его микрочастиц в случаях, когда возникновение конвективных механизмов невозможно. Этот вид теплообмена возникает при разной температуре соприкасающихся веществ.
Совокупность тепловых значений в различных точках вещества называют температурным полем. Такое поле может быть стационарным – если тепловой показатель всех точек не изменяется с течением времени. И стационарным – при изменяющейся температуре в точках в течение какого-нибудь промежутка времени.
Понятие коэффициента теплопередачи
С точки зрения физики явление передачи тепла можно объяснить стремлением любой системы занять положение равновесия, при котором затраты энергии будут минимальными. Система, выведенная из равновесия посредством теплового изменения какой-либо её части, стремится в кратчайшее время восстановить равновесие, выравнивая температуру в разных точках. Микрочастицы переносят тепло, выравнивая температурный показатель– это и есть теплопередача.
Явление переноса тепла мы наблюдаем в твёрдых телах, в жидкостях и в меньшей мере – в газах.
Возьмём некий объём идеального газа, заключённый между двумя плоскими стенками. При различающейся температуре этих стенок Т1 и Т2 для каждой из них соответственно, создастся тепловой поток микрочастиц, который переносит тепло от более тёплой стенки к более холодной, выравнивая разницу температур. На этом явлении строится, например, утепляющий эффект окна. Стёкла имеют высокую способность передавать тепло, но заключённый между ними воздух является проводником тепла, в 160 худшим, чем стекло.
Коэффициент теплопередачи – это величина, которую нам помогает вычислить полуэмпирическая формула, она характеризует способность вещества переносить определённое количество тепла за единицу времени.
Для различного рода расчётов существует таблица теплопроводности материалов, поскольку это имеет огромное практическое значение. От этой величины зависит, как можно использовать вещество – как термоизолятор или как теплопроводник.
Коэффициент теплопроводности газов в природе
Формула говорит о том, что идеальный газ прямо пропорционален температуре.То же самое мы наблюдаем у метана, углекислоты, гелия и других природных веществ.
В таблице 1 приведены коэффициенты теплопередачи различных веществ при разных температурах.
Исследования способности проводить тепло в различных условиях проводились, как правило, на примере метана и углекислоты. Это объясняется тем, исследования метана, как самого распространённого в природе, представляют большой интерес. Использование же в экспериментах углекислоты объясняется дешевизной и тем, что её свойства заметно отличаются от свойств прочих природных веществ.
Коэффициент теплопередачи идеального газа не зависит от давления. Способность переносить тепло у природных веществ при различных показаниях давления в умеренном диапазоне тоже будет практически одинаковой. Но это справедливо, если речь идёт не о вакууме или не о слишком высоких давлениях. При крайне низких или крайне высоких давлениях теплопроводность газа будет расти вместе с уровнем теплоты.
В таблице 2 мы видим значения коэффициента теплопроводности для различных газов. Обратите внимание, что величина коэффициента заметно отличается – например, у метана она практически в два раза больше, чем у углекислого газа. Это говорит о том, что применение углекислого газа в качестве термоизолятора будет более обоснованным, чем применение метана или любого другого газа с высокой способностью передавать тепло.
Общие сведения о теплопередаче Теория теплопередачи выделяет три вида передачи тепла в пространстве (или теплообмена): теплопроводность; конвекция; термоизлучение. Теплопроводность – это молекулярный процесс, который характеризуется передачей тепла при непосредственном соприкосновении…
Источник