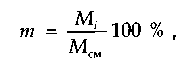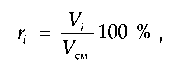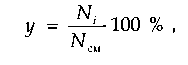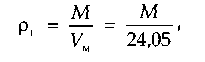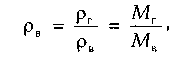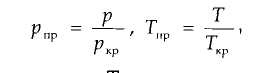§ 3. Состав и классификация природных газов
Природные газы, добываемые из чисто газовых, нефтяных и газоконденсатных месторождений, состоят из углеводородов гомологического ряда метана с общей формулой CnH2n+2, a также неуглеводородных компонентов: азота (N2), углекислого газа (СО2), сероводорода (H2S), меркаптанов (RSH), редкоземельных (инертных) газов (гелия, аргона, криптона, ксенона,), ртути. Число углеродных атомов в молекуле углеводородов п может достигать 18 и более.
Метан (СН4), этан (С2Н6) и этилен (С2Н4) при обычных условиях давления (р=0,1 МПа) и температуры (Т=288—303 К) являются газами.
Пропан (С3Н8), пропилен (С3Н6), изобутан (i-C4H10), нормальный бутан (n=С4Н10), бутилены (С4Н8) при атмосферных условиях находятся в парообразном (газообразном) состоянии, при повышенных давлениях — в жидком состоянии. Они входят в состав жидких углеводородных газов.
Углеводороды, начиная с изопентана (i-C5H12) и более тяжелые (17п>5), при атмосферных условиях находятся в жидком состоянии. Они входят в состав бензиновой фракции.
Углеводороды, в молекулу которых входит 18 атомов углерода (от C18H38) и более расположенных в одну цепочку, при атмосферных условиях находятся в твердом состоянии.
В табл. III. 1 приведены составы сухого газа, жидких газов и газового бензина.
Таблица III.I Составы сухого газа, жидких газов и газового бензина
Пропан, пропилен, изобутан, нормальный бутан, бутилен
Изопентан, нормальный пентан, амилены, гексан и др.
Природные газы подразделяются на три следующие группы.
1. Газы, добываемые из чисто газовых месторождений и представляющие собой сухой газ, свободный от тяжелых углеводородов.
2. Газы, добываемые вместе с нефтью. Это физические смеси сухого газа, пропан-бутановой фракции (жидкого газа) и газового бензина.
3. Газы, добываемые из газоконденсатных месторождений,— смесь сухого газа и жидкого углеводородного конденсата. Углеводородный конденсат состоит из большого числа тяжелых углеводородов, из которых можно выделить бензиновые, лигроиновые, керосиновые, а иногда и более тяжелые масляные фракции.
В табл. III.2 III.3, III.4 приведены составы природных газов некоторых чисто газовых, нефтяных и газоконденсатных месторождений.
Таблица III.2- Объемный состав природных газов, добываемых из чисто газовых месторождений (в %)
Источник
1.4. Состав и свойства природного газа
Природный газ представляет собой смесь предельных углеводородов состава СпН2п+2, в которой содержится метан, этан, пропан, бутан и иногда пары более тяжелых углеводородов. Часто в состав природных газов входят азот N2 (до 40 % по объему), углекислота СО2, сероводород H2S и редкие газы.
В газе газовых и газоконденсатных месторождений обычно преобладает метан; его доля достигает 98,8 %; в нефтяном (попутном) газе доля метана намного меньше, однако увеличивается доля более тяжелых углеводородов — этана, пропана и бутана [5, 7, 13, 41].
Состав газовых смесей выражается в виде массовой, объемной или молярной доли компонентов в процентах. Массовая доля в процентах какого-либо компонента газовой смеси представляет собой отношение массы этого компонента к массе всей смеси:
где Мi — масса i-го компонента; Mсм — масса смеси.
Объемная доля (%) какого-либо компонента в смеси газов равна отношению объема компонента к объему всей смеси:
где Vi — объем /-го компонента в смеси; Vсм — объем всей смеси.
Молярная доля компонента определяется аналогично и может быть представлена в виде
где Ni — число молей г-го компонента в смеси; Ncm — суммарное число молей газа в смеси.
Физические свойства природного газа зависят от его состава, но в целом близки к свойствам метана как основного компонента смеси.
Плотность природного газа можно определить взвешиванием или вычислить, зная молекулярную массу смеси М:
где Vm — объем моля газа при стандартных условиях, м 3 .
Обычно рг находится в пределах 0,73— 1,0 кг/м 3 . В расчетах часто используют более удобную величину — относительную плотность Δ так как значение ее практически не зависит от давления и температуры. За величину сравнения принимают плотность воздуха
где МГ — масса газа; Мв — масса воздуха.
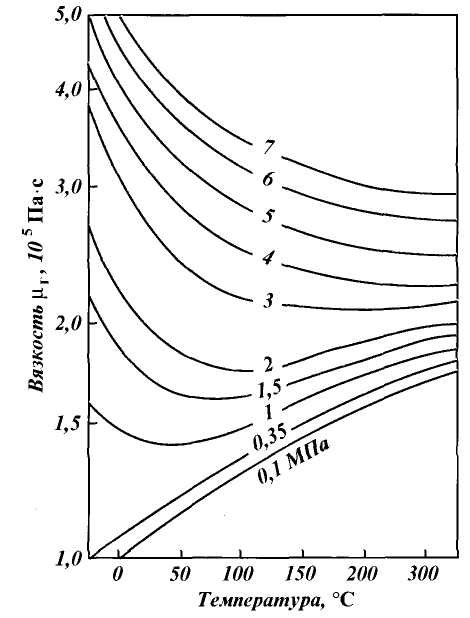
Относительная плотность газа изменяется от 0,50 до 1,0. Плотность индивидуальных компонентов углеводородных газов (и сероводорода), за исключением метана, больше единицы. При всех расчетах, связанных с движением газа, используется вязкость. Аналитические зависимости вязкости смеси от вязкости входящих в смесь компонентов сложны и имеют недостаточную точность. В связи с этим на практике вязкость определяют по экспериментальным графикам, один из которых приведен на рис. 1.2.
Рис. 1.2. Зависимость вязкости природного газа μ (при Δ = 0,6) от температуры
Состояние газа характеризуется давлением р, температурой Т и объемом V. Соотношение между этими параметрами определяется законами идеальных газов (Бойля — Мариотта, Гей-Люссака и др.), которые имеют чрезвычайно большое
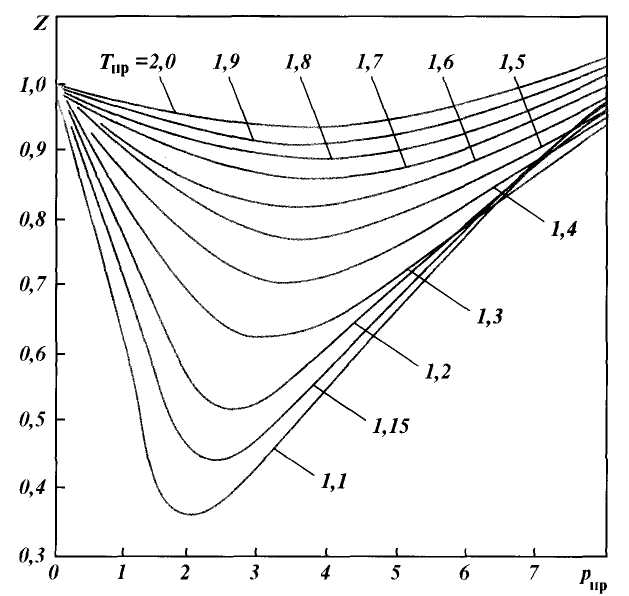
Рис. 1.3. Зависимость коэффициента сжимаемости природного газа от приведенного давления при различных температурах
pV = ZMRT,
где Z — коэффициент сжимаемости; М — масса газа; р — давление; V — объем газа; R — газовая постоянная; Т — абсолютная температура.
Для нефтяных газов значение коэффициента сжимаемости Z можно найти приближенно
Относительная плотность газа
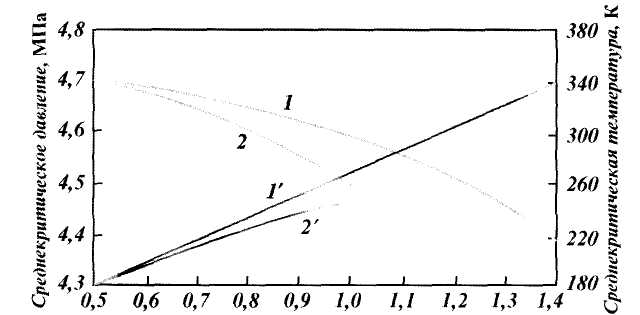
Рис. 1.4. Зависимость среднекритического давления (1, 2) и температуры (1‘ 2′ ) природного газа от относительной плотности:
1, 1‘ — газовое месторождение; 2, 2′ — газоконденсатное месторождение
по графикам Брауна, представленным на рис. 1.3. Коэффициенты сжимаемости Z на этом графике зависят от приведенных давления рпр и температуры Тпр , значения которых можно определить по формулам
где р и Т — соответственно давление и температура газа; ркр и Ткр — критические давления и температура.
Рис. 1.5. Энтальпия природного газа в зависимости от давления и температуры (при относительной плотности газа Δ = 0,6)
газа на конечном участке изменения его давления. Эту величину обычно находят по кривым теплосодержания (рис. 1.5). Зная давление газа и его температуру при одном состоянии, по этим кривым можно найти температуру газа после дросселирования. Для этого от первоначальной точки по линии равного теплосодержания следует переместиться в точку нового значения давления. Температура, соответствующая этой точке, явится искомой величиной. Изменение температуры газа при снижении давления на 0,1 МПа называется коэффициентом Джоуля — Томсона. Эта величина составляет 0,25 — 0,35 °С на 0,1 МПа (1 атм).
Источник