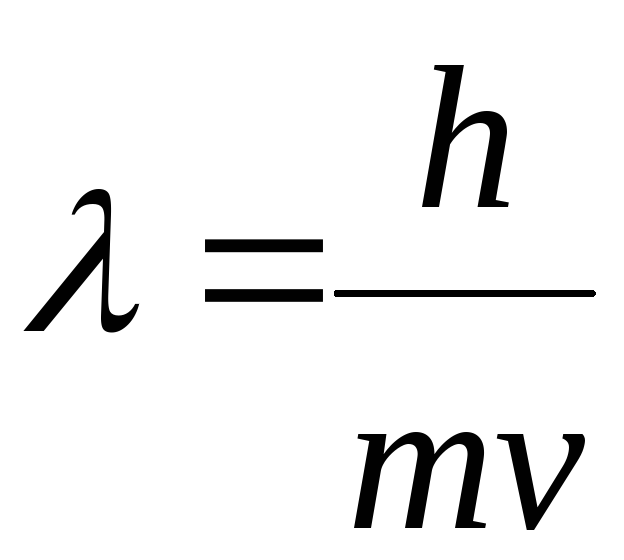Строение атома и периодический закон
Атом — это наименьшая электронейтральная частица, которая химически неделима.
Выделяют несколько моделей строения атома:
- Модель Резерфорда или планетарная модель. Суть данной модели заключается в том, что:
- центральное место атома занимает положительно заряженное ядро;
- весь положительный заряд и масса атома сосредоточены в ядре;
- число электронов, которые окружают ядро, равно заряду ядра.
- Модель Бора:
- движения электронов могут быть не только произвольными, но и стационарными;
- при стационарном движении электрон не поглощает и не излучает энергию.
- Квантовая модель (современная). В данной теории учитывается волновые свойства электронов. Также для нее характерны следующие положения:
- электрон обладает двойственной природой, то есть как частица он обладает зарядом и массой, а если учитывать волновые свойства, то поток электронов способен к дифракции;
- принцип неопределенности: чем точнее измеряется скорость, тем выше становится неопределенность в координате;
- электрон может располагаться в любой области околоядерного пространства (в орбитали);
- ядро состоит из протонов и нейтронов (суммарное число протонов и нейтронов дает массовое число элемента).
Электрон — отрицательно заряженная частица, заряд нейтрона равен 0, протон имеет положительный заряд.
Различные виды атомов называются нуклидами. Их можно охарактеризовать двумя параметрами элемента из трех существующих. К таким параметрам относятся: массовое число А, заряд атома Z (соответствует числу протонов) и количество нейтронов N. Существует взаимосвязь между ними:
Если нуклиды имеют одинаковый заряд и различаются по количеству нейтронов и массовому числу, то их называют изотопами.
Периодический закон
Впервые периодический закон был сформулирован Д. И. Менделеевым. Он считал, что формы и свойства простых веществ и их соединений находятся в периодической зависимости от величины атомного веса элемента.
Современная же формулировка периодического закона гласит, что свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от порядкового номера элемента (величины заряда ядра атома).
Источник
2.4. Двойственная природа электрона
В 1905 г. А. Эйнштейн предсказал, что любое излучение представляет собой поток квантов энергии, называемых фотонами. Из теории Эйнштейна следует, что свет имеет двойственную (корпускулярно-волновую) природу.
В 1924 г. Луи де Бройль (Франция) выдвинул предположение, что электрон также характеризуется корпускулярно-волновым дуализмом. Позднее это было подтверждено на опытах по дифракции на кристаллах. Де Бройль предложил уравнение, связывающее длину волны λ электрона или любой другой частицы с массой т и скоростью ν,
Волны частиц материи де Бройль назвал материальными волнами. Они свойственны всем частицам или телам. Однако, как следует из уравнения (5), для микротел длина волны настолько мала, что в настоящее время не может быть обнаружена. Так, для тела с массой 1000 кг, двигающегося со скоростью 108 км/ч (30 м/с)
В 1927 г. В. Гейзенберг (Германия) постулировал принцип неопределенности, согласно которому положение и импульс движения субатомной частицы (микрочастицы) принципиально невозможно определить в любой момент времени с абсолютной точностью. В каждый момент времени можно определить только лишь одно из этих свойств. Э. Шредингер (Австрия) в 1926 г. вывел математическое описание поведения электрона в атоме.
Работы Планка, Эйнштейна, Бора, де Бройля, Гейзенберга, а также Шредингера, предложившего волновое уравнение, заложили основу квантовой механики, изучающей движение и взаимодействие микрочастиц.
2.5. Квантово – механическая модель атома
В настоящее время строение атома рассматривается с позиций квантовой или волновой механики, в основе которой лежит представление о двойственной природе электрона: электрон, как и любая частица микромира, обладает одновременно свойствами частицы (массой m и скоростью передвижения v) и свойствами волны (длиной волны ):
где: h – постоянная Планка, наименьший квант энергии лучеиспускания.
Волновая механика описывает движение электрона в атоме как распространение волны по всему объему атома. Каждое мгновение электрон может находиться в любой части пространства вокруг ядра.
Путь, описываемый электроном, сливается в расплывчатое электронное облако, в котором плотность отрицательного заряда соответствует вероятности обнаружения электрона.
Плотность электронного облака максимальна на некотором расстоянии от ядра и характеризует удаленность электрона от ядра и запас его энергии. Состояние электрона в атоме математически описывается волновым уравнением.
Представление об электронном облаке – это квантово-механическая модель электрона в атоме. Понятию «электронное облако» соответствуют также понятия «атомная орбиталь», «квантовая ячейка», «энергетическая ячейка». Электронные облака (атомные орбитали) могут быть разного размера, различной формы, по-разному ориентированы в пространстве. Все это соответствует определенному энергетическому состоянию электрона.
В многоэлектронных атомах все электроны распределяются по энергетическим уровням (электронным слоям или электронным оболочкам). В пределах энергетического уровня электроны распределяются по подуровням (подоболочкам). Полная характеристика каждого электрона определяется значениями четырех квантовых чисел. Многоэлектронный атом подчиняется принципу Паули (1925 г.): в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел:
1. Главное квантовое число (n) характеризует энергетический уровень и отражает размеры электронного облака. n принимает значения целых чисел 1, 2, 3, 4, 5, 6, 7… (или в буквенном изображении K, L, M, N, O, P, Q…). С увеличением n (удалением электрона от ядра) энергия электрона возрастает. Число энергетических уровней в невозбужденном атоме равно номеру периода, в котором находится элемент в периодической системе. Например, электроны атома натрия распределяются по трем уровням, которым соответствуют значения главного квантового числа n=1 (K), n=2 (L), n=3 (M).
2. Орбитальное квантовое число l характеризует энергетический подуровень и отражает форму электронного облака. Усложнение формы электронного облака связано с возрастанием энергии электрона. Орбитальное квантовое число может изображаться буквами s, p, d, f или цифрами, которые в пределах данного энергетического уровня (с данным значением n) могут принимать целочисленные значения от 0 до (n-1).
Для обозначения подуровня указывают цифрой главное квантовое число (т.е. обозначают, в каком уровне находится электрон и каков размер его электронного облака) и буквой указывают орбитальное квантовое число (т.е. характеризуют форму этого облака). например, подуровни 1s, 2s, 2p, 4s, 3d, 5f и т.д.
Источник
Амфотерные гидроксиды — вещества двойственной природы
Существуют гидроксиды, которые вступают во взаимодействие и с кислотами, и с основаниями в зависимости от условий. Эти соединения, проявляющие двойственную природу, называются амфотерные гидроксиды. Они образованы катионом металла и гидроксид-ионом, как и все основания. Способностью выступать в роли кислоты и основания обладают только те гидроксиды, которые в своем составе содержат такие металлы: Ве, Zn, Al, Pb, Sn, Ga, Cd, Fe, Cr(ІІІ) и др. Как видно из Периодической системы Д.И. Менделеева, гидроксиды с двойственной природой образуют металлы, которые находятся ближе всего к неметаллам. Считают, что такие элементы являются переходными формами, и деление на металлы и неметаллы довольно условно.
Амфотерные гидроксиды представляют собой твердые порошкообразные мелкокристаллические вещества, которые чаще всего имеют белую окраску, не растворяются в воде и слабо проводят ток (слабые электролиты). Однако некоторые из этих оснований могут растворяться в кислотах и щелочах. Диссоциация «двойственных соединений» в водных растворах происходит по типу кислот и оснований. Связано это с тем, что сила удерживания между атомами металла и кислорода (Me— О) и между атомами кислорода и водорода (О — Н) практически равная, т.е. Ме — О — Н. Поэтому эти связи будут разрываться одновременно, а данные вещества -диссоциировать на катионы Н+ и анионы ОН-.
Подтвердить двойственную природу данных соединений поможет амфотерный гидроксид — Be(OH)2. Рассмотрим взаимодействие гидроксида бериллия с кислотой и основанием.
2. Be(OH)2 + 2KOH – K2 [Be(OH)4] – калий тетрагидроксобериллат.
В первом случае проходит реакция нейтрализации, итогом которой является образование соли и воды. Во втором случае продуктом реакции будет комплексное соединение. Реакция нейтрализации типична для всех без исключения гидроксидов, а вот взаимодействие с себе подобными характерно только для амфотерных. Такие двойственные свойства будут проявлять и другие амфотерные соединения – оксиды и сами металлы, которыми они образованы.
1. Термическое разложение, продукты реакции – соответствующий оксид и вода: Ве(OH)2 –ВеО+Н2О.
Также нужно запомнить, что существуют вещества, с которыми амфотерные гидроксиды не взаимодействуют, т.е. химическая реакция не идет, это:
- неметаллы;
- металлы;
- нерастворимые основания;
- амфотерные гидроксиды.
- средние соли.
Получают эти соединения путем осаждения щелочью соответствующих растворов солей:
Соли некоторых элементов в ходе данной реакции образуют гидрат, свойства которого практически полностью соответствует таковым у гидроксидов с двойственной природой. Сами же основания с двойственными свойствами входят в состав минералов, в виде которых и встречаются в природе (боксит, гетит и др.).
Таким образом, амфотерные гидроксиды – это неорганические вещества, которые в зависимости от природы вещества, вступающего с ними в реакцию, могут выступать как основания или как кислоты. Чаще всего им соответсвуют амфотерные оксиды, содержащие соответствующий металл (ZnO-Zn(OH)2; BeO — Be(OH)2) и т.д.).
Источник