Химический состав природных вод
1.1. Основные этапы формирования химического состава природных вод
Процесс формирования химического состава природных вод осуществляется в несколько этапов, на каждом из которых определяющую роль играют различные факторы. Первым этапом формирования поверхностных вод является взаимодействие их с атмосферой. Еще находясь в атмосфере, мельчайшие капли воды при своем падении на Землю увлекают из воздуха различные вещества. Источником минерального состава атмосферных осадков являются вулканические выбросы, оксиды азота, образующиеся при грозовых разрядах, а также антропогенное загрязнение воздуха, обусловленное промышленными выбросами и работой автотранспорта. В состав атмосферных осадков входят и радиоактивные загрязнения, и пестициды. Общее количество веществ, растворенных и взвешенных в дождевой воде, колеблется в пределах 10 – 20 мг/дм 3 . Это, прежде всего, газы – азот, кислород, диоксид углерода, оксиды азота и серы, ионы солей (SO4 2– ,Cl – , HCO3 – ,NO3 – ,NH4 + ,Ca 2+ ,Mg 2+ ,Na + ). Кроме того, дождевые воды содержат микроорганизмы и пыль в виде механических примесей. Вторымэтапом формирования состава природных вод является взаимодействие выпавших атмосферных осадков с почвенным покровом, при этом важную роль играет наличие растительности и ее характер. Приобретаемый при соприкосновении с почвой химический состав воды зависит от характера почвы. Вода, фильтруясь через почву, выщелачивает ее растворимые части, изменяя при этом свой состав: увеличивается содержание ионов и органических веществ, изменяется содержание растворенных газов. При взаимодействии воды с почвой содержание кислорода в воде уменьшается, а оксида углерода (IV) увеличивается, что объясняется окислением органических веществ. Наряду с растворением солей наблюдаются явления адсорбции и ионного обмена. Если вода фильтруется через бедные солями торфянисто-тундровые или болотные почвы, то она обогащается большим количеством органических веществ и лишь незначительно — ионами. Больше обогащают ионами воду черноземные и каштановые почвы, еще больше солонцеватые. Значительной ионообменной способностью обладают многие почвы, в особенности чернозем и торф, что связано с наличием в них гуминовых кислот. Третьими основным этапом формирования химического состава природных вод является их взаимодействие с минералами литосферы. Породы, слагающие земную кору, могут обогащать природные воды солями в результате выветривания изверженных и образовавшихся из них обломочных пород и растворения солей, находящихся в осадочных породах. Основная часть минералов, образовавшихся в глубинных слоях Земли, попав в условия биосферы, начинает постепенно изменяться и разрушаться. Это разрушение называют выветриванием. В зависимости от того, какому агенту принадлежит ведущая роль в разрушении горных пород, различают:
- физическое выветривание;
- химическое выветривание;
- биологическое выветривание.
Обычно они происходят одновременно. Химическое выветривание горных пород происходит под действием воды и воздуха в результате различных химических реакций, прежде всего гидролиза, гидратации, ионного обмена, окисления, карбонатизации и обычного химического растворения. Для минерализации воды особое значение имеет выветривание различных алюмосиликатов, которые разлагаются, главным образом при гидролизе. Так, гидролиз обычного полевого шпата (ортоклаза) приводит к образованию нового силиката – каолина, составляющего основу различных глин: 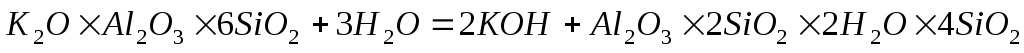
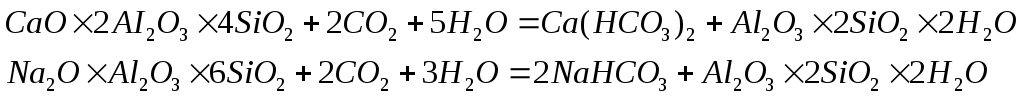
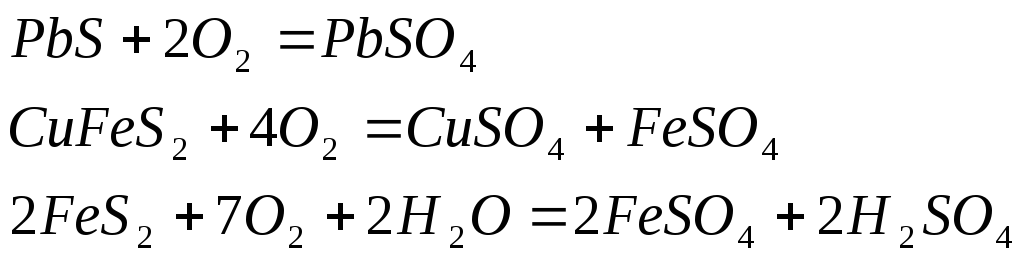

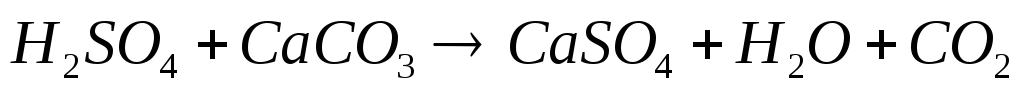
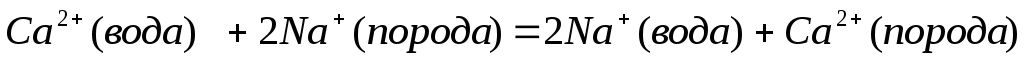
Для продолжения скачивания необходимо пройти капчу:
Источник
Химический состав, классификация и некоторые особенности природных вод
На планете есть большое количество воды, из которой 97,4 % по массе составляют морские и океанские воды. Около 71 % поверхности Земли покрыто водой. Однако никогда и нигде вода в природе не бывает чистой из-за того, что она является наилучшим природным растворителем. При контакте с водой растворяются прежде всего твёрдые вещества – породы, минералы, соли. Вода растворяет также газы, что выходят из глубины Земли (СО2, H2S, CH4 и др.), а в контакте с атмосферным воздухом в водах растворяются О2, СО2, N2 и т.д. Большое значение при этом имеет растворённая угольная кислота, которая при взаимодействии с карбонатсодержащими минералами переводит их в хорошо растворимые гидрокарбонаты. Кроме того, в природных водах всегда есть значительное количество органических веществ – продуктов жизнедеятельности и разложения водных организмов (гидробионтов).
Большое разнообразие качественного и количественного химического состава природных вод не дает возможности классифицировать их по какому-либо одному признаку. С точки зрения аналитической химии наиболее приемлемой является классификация по содержанию основных солевых компонентов, которые составляют так называемую матрицу объекта анализа. Химический состав матрицы в большом количестве случаев является одним из важных факторов, который нужно иметь в виду при выборе метода анализа, подготовки пробы к анализу и выполнения аналитических операций.
Количественный состав матрицы природных вод характеризуется суммой солевых компонентов (главных ионов). Она создаёт так называемую минерализацию воды, которая выражается через Σi (г/кг). По величине минерализации природные воды подразделяются на 4 группы:
Подразделения вод согласно минерализации
Минерализация Σi г/кг
Качественный состав матрицы природных вод можно характеризовать соотношением шести главных ионов, которые могут присутствовать в количестве 12,5 % — экв. Такими ионами являются: Na + , Mg 2+ , Ca 2+ , Cl — , SO4 2- и HCO3 + CO3 2- . По преобладающему содержанию ионов природные воды делятся на 3 класса: гидрокарбонатные и карбонатные (HCO3 + CO3 2- ), сульфатные (SO4 2- ) и хлоридные (Cl — ). В свою очередь, каждый класс по преобладающему наличию катионов делится на 3 группы: кальциевую, магниевую и натриевую. Так, поверхностные воды Украины являются в основном гидрокарбонатно-кальциевыми, морские воды – хлоридонатриевые, а некоторые колодезные воды – сульфатно-магниевые («гирка вода») и т.д.
Особое внимание на качественный и количественный состав матрицы (главных ионов) природных вод необходимо обращать при их концентрировании и при определении некоторых химических ингредиентов, в частности, микрокомпонентов. Например, при выпаривании гидрокарбонатно-кальциевых вод может образоваться осадок Са СО3, на котором способны адсорбироваться много органических соединений и ионов металлов. При определении органического углерода в хлоридных водах окислением бихроматом необходимо создать условия для предотвращения окисления хлорид — ионов; при фотометрическом определении ионов аммония реактивом Неслера в сульфатно-натриевых водах необходимо предотвратить образование малорастворимого гидроксида Mg и т.д.
Химические ингредиенты природных вод делятся на 5 основных групп:
- Растворенные газы – О2, СО2, Н2S, СН4 и т. д.
- Главные ионы (солевые компоненты) – НСО3, СО3 2- , Cl — , SO4 2- , Na + , + K + , Mg 2+ , Ca 2+ .
- Биогенные элементы – NH4 + , NO2 — ,NO — 3, азот органический (Nорг), орто и натрофосфаты, фосфор органический (Рорг), ортосиликаты, Fe (II, III).
- Микроэлементы – Mn, Cn, Zn, CO, MO (биометаллы), Ni, Cr, Cd, Pb, Hg, F и др. компоненты (неорганические промышленные загрязнители)
- Органические вещества – углерод органический (Сорг), белки, амины, аминокислоты, карбонаты и оксикарбонатовые кислоты, сложные эфиры, углеводы, жиры, карбонильные соединения природного и антропогенного происхождения.
Источник