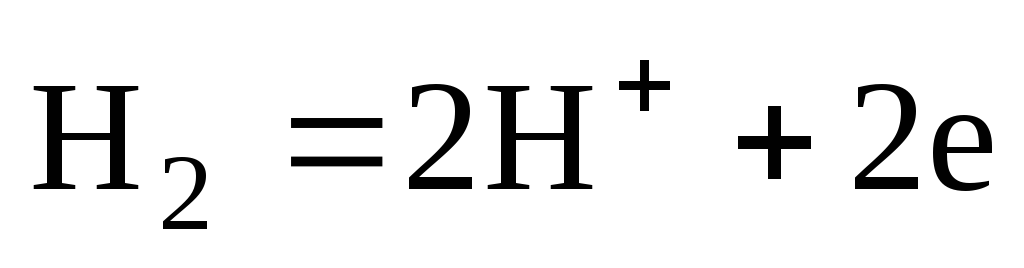- Химия. 11 класс
- § 18.1. Окислительно-восстановительные реакции. Важнейшие окислители и восстановители. Окислительно-восстановительные процессы в природе, технике, быту
- 7. Окислительно-восстановительные реакции в окружающей среде. Влияние рН и растворенного кислорода на окислительно-восстановительные процессы.
Химия. 11 класс
§ 18.1. Окислительно-восстановительные реакции. Важнейшие окислители и восстановители. Окислительно-восстановительные процессы в природе, технике, быту
Окислитель — это вещество, в состав которого входят атомы, присоединяющие к себе электроны в процессе химической реакции. Во время реакции эти атомы восстанавливаются, при этом их степень окисления понижается.
Окислительные свойства наиболее выражены у веществ, со свойствами которых вы уже знакомы или познакомитесь далее:
- • простые вещества — галогены, кислород и озон;
- • пероксид водорода , восстанавливаются атомы кислорода в степени окисления −1 ;
- • концентрированная серная кислота, восстанавливаются атомы серы в степени окисления +6;
- • азотная кислота и нитраты, восстанавливаются атомы азота в степени окисления +5;
- • кислоты (галогеноводородные, фосфорная, разбавленная серная), восстанавливаются атомы водорода в ионе водорода;
- • кислородсодержащие кислоты хлора и их соли (, ), восстанавливаются атомы хлора;
- • соединения марганца в высших степенях окисления (, ) , восстанавливаются атомы марганца;
- • соединения хрома (, ), восстанавливаются атомы хрома;
- • соли железа(III), меди(II), серебра(I), восстанавливаются атомы металлов.
Восстановитель — это вещество, в состав которого входят атомы, отдающие электроны в процессе окислительно-восстановительной реакции. Во время реакции эти атомы окисляются, при этом их степень окисления повышается.
Приведём примеры важнейших восстановителей, свойства которых вы будете рассматривать, изучая материал глав VI и VII:
- • простые вещества — металлы (например, Na, Fe, Zn, Al, Sn и др.);
- • простое вещество — водород;
- • углерод, оксид углерода(II) и многие органические соединения (например, альдегиды), окисляются атомы углерода;
- • сероводород, сульфиды и сульфиты, окисляются атомы серы;
- • бромиды и йодиды (например, KI), окисляются атомы галогена;
- • соли железа(II), окисляются атомы железа в степени окисления +2.
Разумеется, приведённый выше перечень веществ не исчерпывает всё разнообразие окислителей и восстановителей. Следует подчеркнуть, что окислители и восстановители различаются по своей силе. Так, например, фтор является одним из самых сильных окислителей, а окислительная способность хлора больше, чем у йода. Для многих веществ окислительная способность зависит от условий реакции. В кислой среде, как правило, окислительная способность более выражена. Ряд веществ в одних условиях обладает окислительной способностью, а в других — восстановительной.
Оценить, будет ли вещество проявлять окислительные или восстановительные свойства, можно, руководствуясь следующими правилами.
Восстановителями являются вещества, содержащие атомы элемента, которые могут проявлять более высокую, чем в данном веществе, степень окисления. Простые вещества металлы всегда являются восстановителями, и в продуктах окисления степень окисления металла имеет только положительные значения.
Атомы неметаллов, входящие в состав соединений в низших степенях окисления, проявляют только восстановительные свойства, например атомы галогена в галогенидах, атомы серы в сульфидах, атомы водорода в гидридах.
Окислителями являются вещества, содержащие атомы элемента, которые могут проявлять более низкую, чем в данном веществе, степень окисления. Сложные вещества, в состав которых входят атомы металлов и неметаллов в высших степенях окисления, всегда являются окислителями, например H2SO4(конц), HNO3, KMnO4, CrO3, HClO4 и др. Понижая свою степень окисления, атомы неметаллов могут приобретать как положительные, так и отрицательные или нулевые значения степени окисления. Окислительная способность веществ в ряду окислителей, как и восстановительная способность веществ в ряду восстановителей, может сильно различаться.
Находясь в промежуточной степени окисления, атомы элемента могут быть окислены более сильным окислителем или восстановлены более сильным восстановителем. Например, железо(II) в оксиде FeO может быть окислено кислородом до Fe(III) или восстановлено углеродом до металлического железа. Свойства как окислителей, так и восстановителей могут проявлять H2O2, FeCl2, SO2, CuCl, углерод, галогены (кроме фтора) и др.
В ряде окислительно-восстановительных реакций часть атомов одного из элементов проявляет свойства окислителя, а другая часть — свойства восстановителя. В результате образуются продукты как окисления, так и восстановления данного элемента. Примерами таких реакций (реакции диспропорционирования) могут служить:
а) взаимодействие оксида азота(IV) с водой:
б) разложение пероксида водорода:
в) взаимодействие хлора с раствором щёлочи с образованием солей хлорноватистой и хлороводородной кислот:
Окислительно-восстановительные процессы распространены в природе. К ним относятся обмен веществ в живых организмах, дыхание, гниение и брожение, фотосинтез. Окислительно-восстановительные процессы сопровождают круговорот веществ в природе. Они протекают при коррозии металлов.
В промышленности и в быту экзотермические окислительно-восстановительные реакции используют при сжигании природного газа, угля, торфа, древесины, нефти и продуктов её переработки. Эти реакции лежат в основе преобразования энергии взаимодействующих химических веществ в электрическую энергию в гальванических и топливных элементах.
В металлургии окислительно-восстановительные процессы используют для восстановления металлов, в химической промышленности — для получения щелочей, кислот, аммиака, спиртов, альдегидов и других продуктов. Подробнее вы познакомитесь со многими окислительно-восстановительными реакциями и их применением при изучении материала глав VI и VII пособия.
Источник
7. Окислительно-восстановительные реакции в окружающей среде. Влияние рН и растворенного кислорода на окислительно-восстановительные процессы.
Для оценки самоочищения природных водоемов от промышленных стоков содержащих тяжелые металлы, нужно знать окислительно-восстановительную обстановку бассейна. Поскольку соединения одного и того же элемента разной степени окисления обладают различной растворимостью и гидролизуемостью, рассеиванию одного элемента способствует окислительная обстановка, а рассеиванию другого – восстановительная.
Например – соли окисленной формы Fe, Mn, Co, Ni, Ti, Pb гидролизуются легче, чем восстановленной, и многие из них при значениях рН, обычной для природных вод, образуют малорастворимые гидроокиси и основные соли. В то же время окисленные соединения V, Cu, Mo гидролизуются труднее, чем восстановленные, и поэтому окислительная обстановка содействует их рассеянию. Характеристика окислительно-восстановительных режимов водоема необходима, и для интерпретации результатов, получаемых при определении микроэлементного состава.
Окислительно-восстановительный потенциал – служит количественной мерой окислительно-восстановительного состояния среды, содержащей вещества с переменной валентностью. Величина потенциала определяется соотношением (окисленных и восстановленных) форм имеющихся веществ, способных окисляться и восстанавливаться.
Уравнение Нернста (1) (под логарифмом – молекулярные концентрации или активности). Значение потенциала выражается в Вольтах или Микровольтах.
Окислительно-восстановительный потенциал природных вод неустойчив и зависит от газового состава воды (О2, H2S, СО2 и др). при выходе подземных вод на земную поверхность или при циркуляции их в хорошо аэрируемых зонах может резко меняться величина потенциала.
Кислород, растворенный в природной воде ведет себя как очень слабый окислитель. Влияние атмосферного кислорода О2 ограничивается созданием слабого окислительного эффекта, а именно:
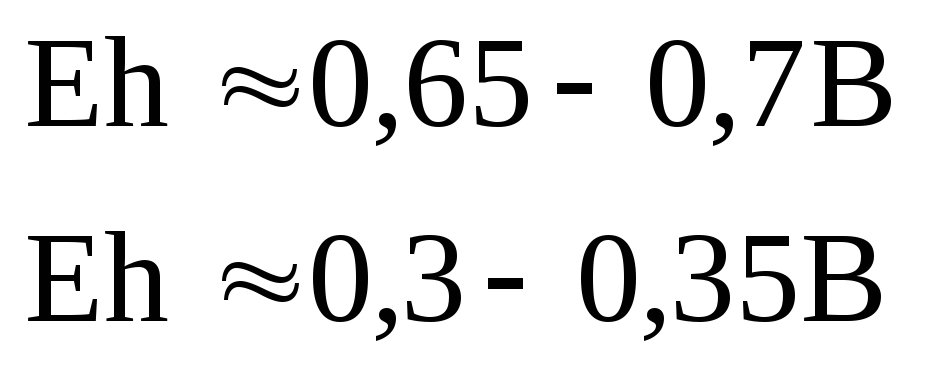



Таким же образом рассмотрим 2-ю реакцию 
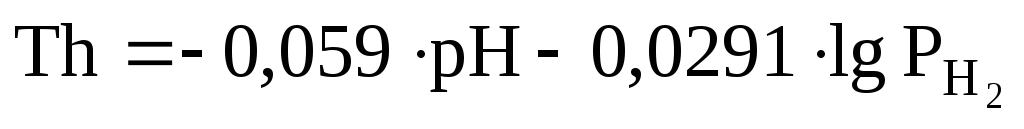
Значение ОВ-процессов в почвообразовании и плодородии велико и проявляется в их влиянии на процессы образования органических и минеральных веществ, их миграцию и аккумуляцию.
Главным окислителем в ночвах является свободный кислород О2 почвенного воздуха и кислород, растворенный в почвенной влаге. Большая часть ОВ-реакций имеет биохимическую природу, т.е. они связаны с проявлением биологических процессов. Для количественной оценки ОВ-состояния почвы используют несколько показателей:
– величина ОВ-потенциала (Eh), который определяется с помощью потенциалометров,
– величина индекса аэробности (rH2), рассчитываемого по формуле — по величинеEh можно судить о преобладании в почве окислительных или восстановительный процессов.
Благоприятное ОВ-состояние (окислительное) при Eh = 450-700мВ
Преобладание восстановительных процессов при Eh = 250-300 мВ и ниже
Величина rH2 = 27 – рубеж перехода от окислительного к восстановительному состоянию
rH2 > 27 – окислительные процессы
Источник