Термодинамические характеристики газа
В технологических расчётах добычи и транспорта газа часто пользуются основными термодинамическими характеристиками природного газа: теплоемкостью, энтропией, энтальпией, теплотой сгорания, теплообменом, теплопроводностью.
Теплоёмкость. Теплоёмкостью называют количество теплоты, необходимое для нагревания единицы массы или объёма вещества на 1° С.
Отношение теплоёмкости в массе системы М называется удельной теплоёмкостью: с = С/М, а отношение теплоемкости к количеству вещества – молярной теплоёмкостью:
Единицей количества теплоты, работы, энергии в системе СИ является джоуль (Дж). Джоуль — работа силы 1 Н при перемещении ею тела на расстоянии 1 м в направлении действия силы:
Теплоёмкость выражается в Дж/К, удельная теплоёмкость – в Дж/(кг·K), молярная теплоёмкость – в Дж/(моль К).
Теплоёмкость природных газов зависит от химического состава и состояния, а также от процесса сообщения им теплоты. В адиабатическом процессе С = 0, в изобарическом С = Ср, в изохорическом С = Сv .
Для газов обычно различают теплоёмкости при постоянном объёме Сv и постоянном давлении Ср.
Теплоёмкости при постоянном объёме Сv связана с процессом, характеризующимся тем, что при неизменности объёма вся энергия, сообщаемая газу в форме теплоты, затрачивается на увеличение внутренней энергии газа. Ср связана с процессом, характеризующимся тем, что, нагревая тело, предоставляют ему возможность расширяться при неизменном давлении. Таким образом, часть сообщенной телу теплоты идет на производство работы расширения. Поэтому Ср > Сv.
Для идеальных газов между Ср и Сv существует следующее соотношение в [кал/моль·°С]:
где R — газовая постоянная.
В области давлений, где газы считаются идеальными, значения теплоёмкостей постоянны. Однако для реальных газов значения теплоёмкости изменяются в зависимости от давления и температуры.
Для смеси газов теплоёмкость определяется по сумме теплоемкости входящих компонентов по формуле
где С1, С2…Сn — теплоёмкости отдельных компонентов смеси;
х1, х2… содержание компонентов в долях единицы.
Отношение теплоёмкости называют показателем адиабаты.
Для практических целей с достаточной точностью можно использовать формулу следующего вида:
где Ср – изобарная теплоёмкость;
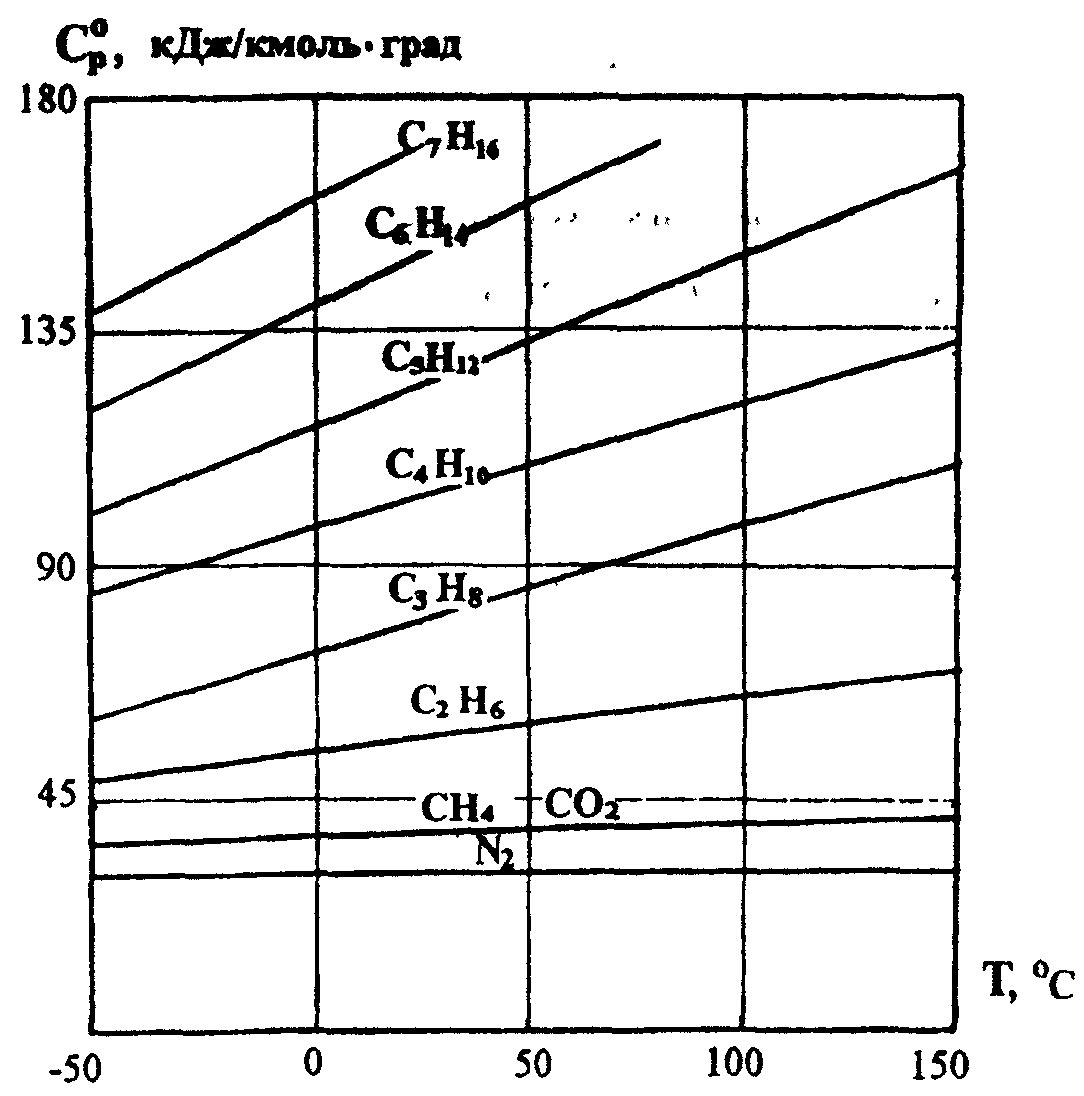
Ср ат – теплоёмкость при атмосферном давлении и заданной температуре, определяемая из рисунка 1 и расчётным путём.
Рисунок 1. Зависимость изобарной молярной теплоёмкости природных газов от температуры при давлении Р = 0,1 МПа
Аналитически Ср ат определяется по формуле следующего вида
где Еi, Fi, Hi, Ni – коэффициенты, определяемые из таблицы 1;
Т – температура, при которой определяется .
Изотермическая поправка на давление ΔСр может быть определена как графическим путем, так и расчётным, например, по формуле следующего вида
где R – газовая постоянная, равная R = 1,986 ккал/моль;
М – молекулярная масса газа;
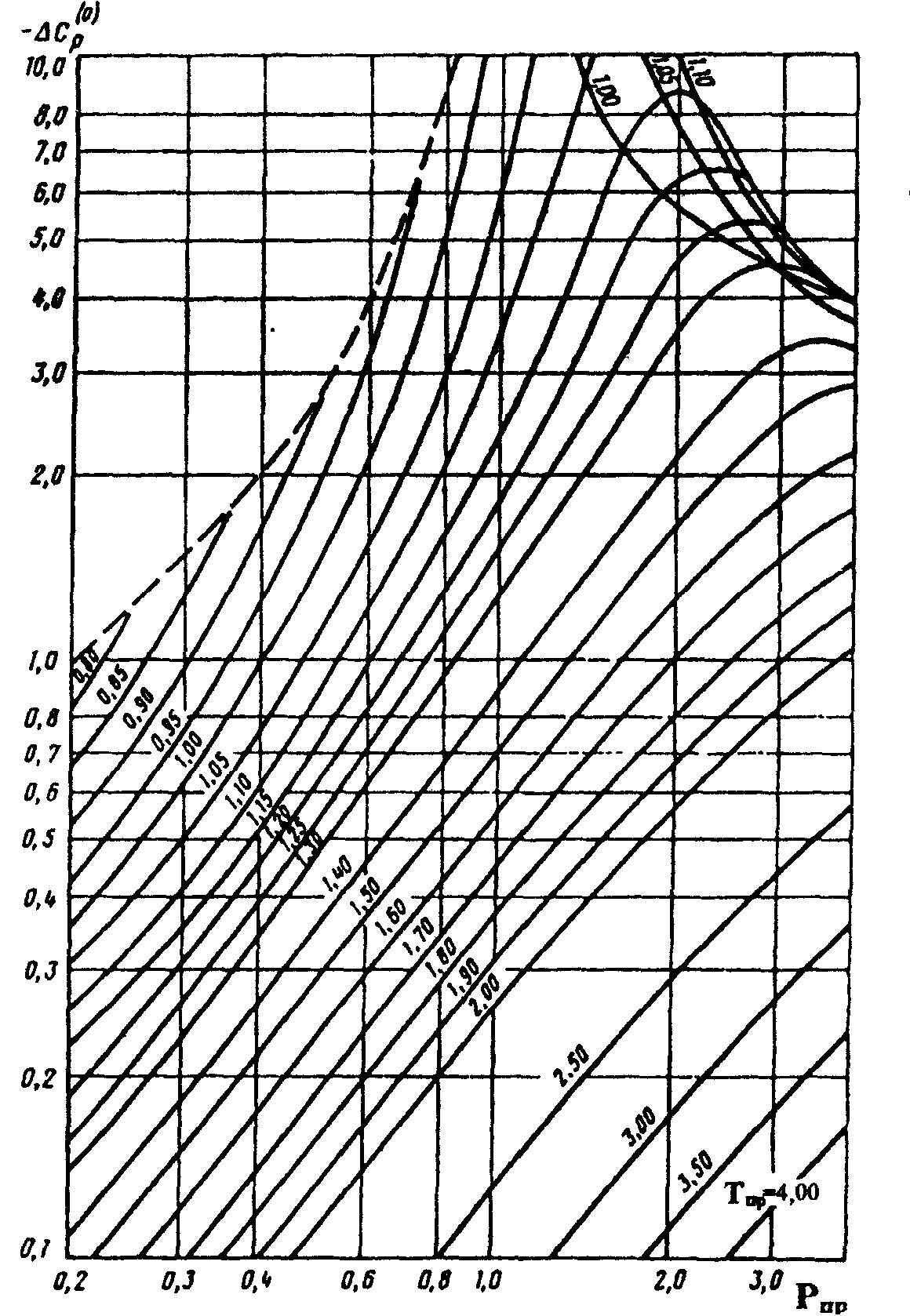
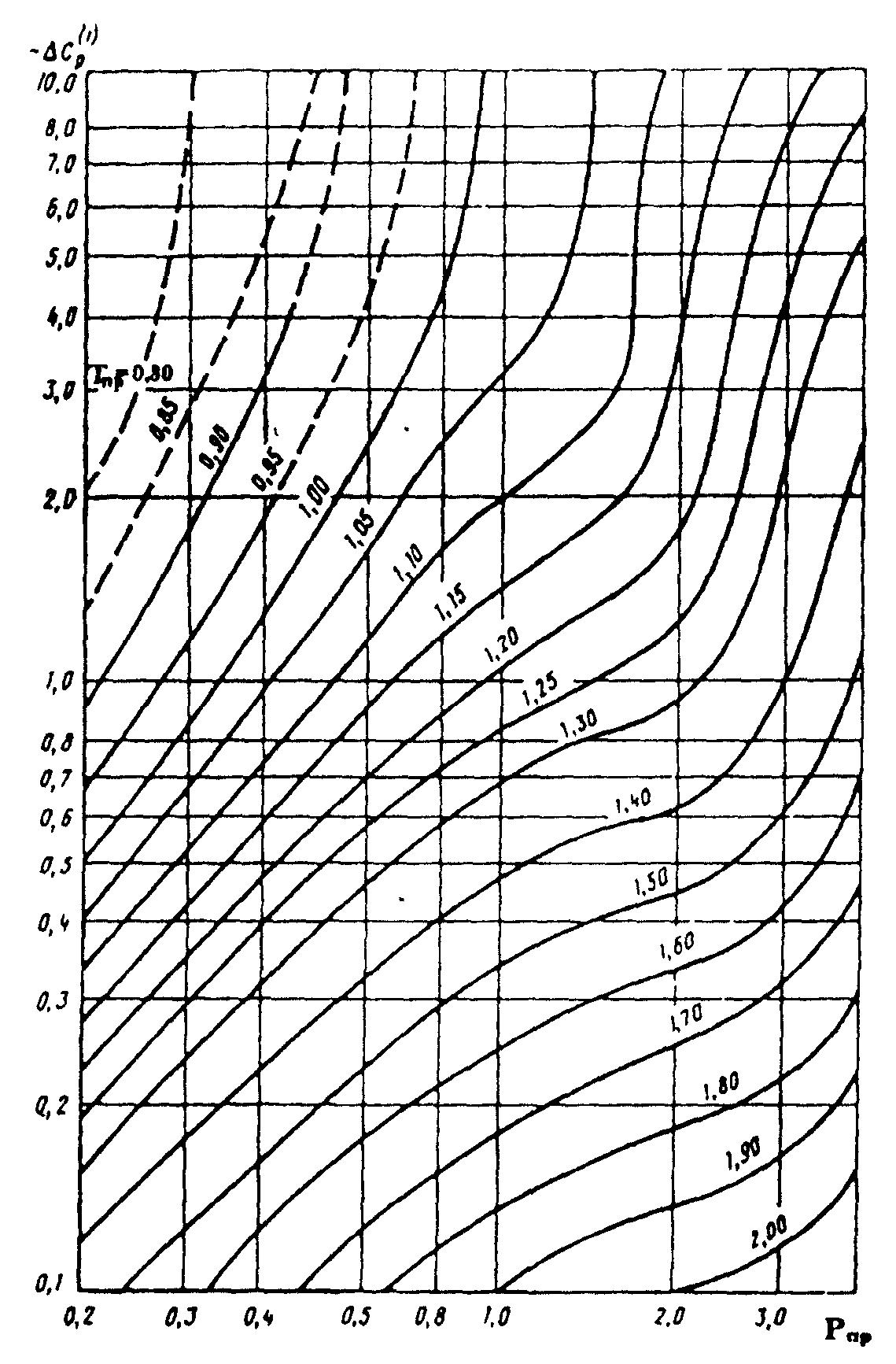
— поправки на теплоёмкость, зависящие от приведенных давления и температуры, определяемые по зависимостям, приведенным на рисунках 2 и 3.
Рисунок 2. Зависимость поправочной от приведенных давления и температуры
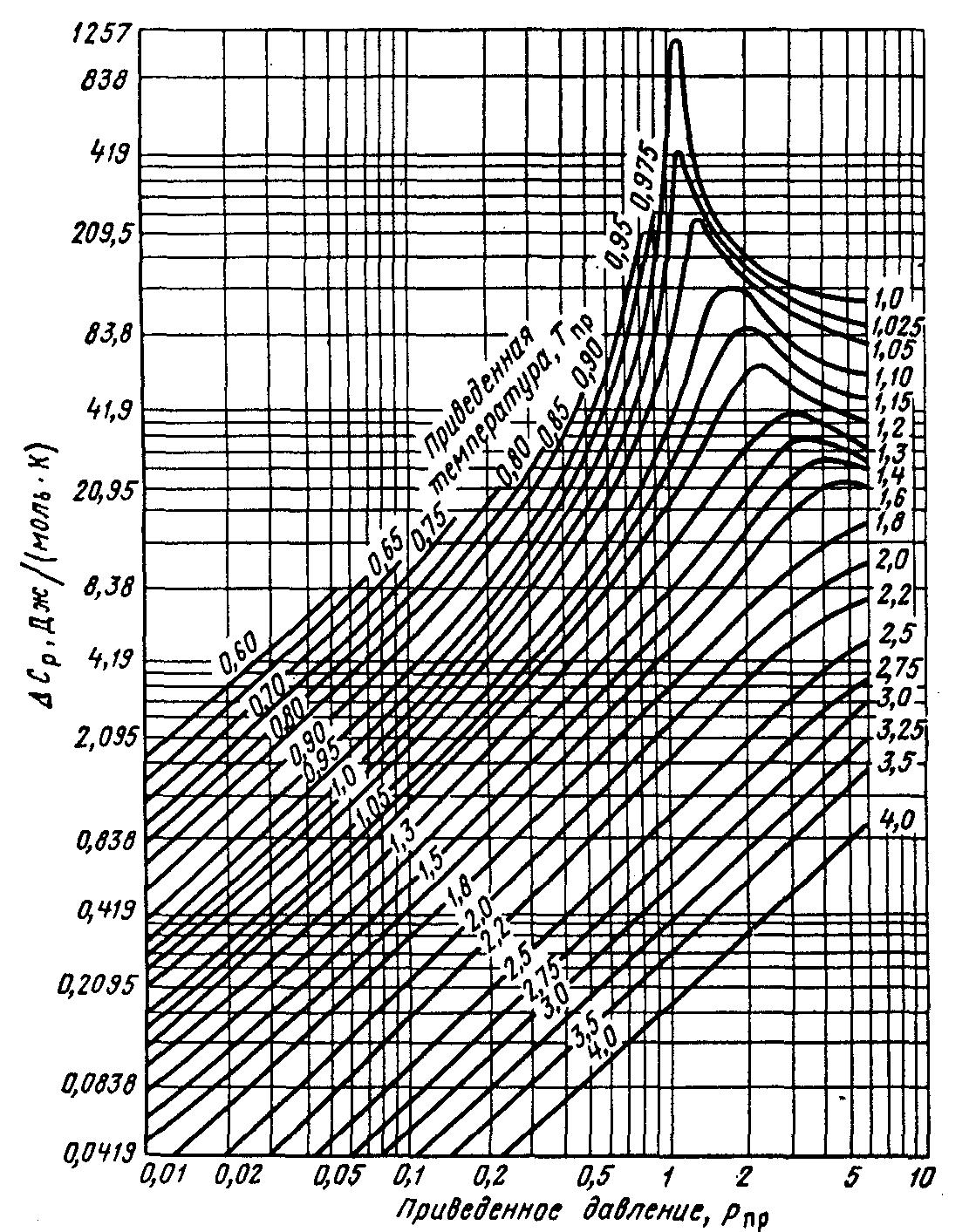
Величина может быть определена и без учёта фактора ацентричности ω по графической зависимости приведенной на рисунке 4.
Рисунок 3. Зависимость поправочной величины
от приведенных давления и температуры
Таблица 1. Значения коэффициентов для зависимости (6)
Фактор ацентричности молекул газа ω определяется аналогично, как и при определении коэффициента сверхсжимаемости Z.
Величину Ср(Р, Т) можно рассчитать по формуле вида
где Т — температура газа, 0 С;
М – молекулярная масса газа.
Рисунок 4 Зависимость изотермической поправки изобарной молярной теплоёмкости от приведенных абсолютных давления Рпр и температуры Тпр
Энтропия. Энтропия S тела — величина, изменение которой равно отношению изменения количества теплоты к абсолютной температуре тела:
где ∆S — изменение энтропии системы, если ей сообщается теплота ∆Q при температуре T.
Единицей измерения энтропии является джоуль на Кельвин (Дж/К).
Энтальпия. Свойство вещества, которое позволяет судить о количестве теплоты, требующейся для изменения его температуры, называется энтальпией Н.
Иными словами, энтальпия — это функция состояния вещества, определяемая равенством:
где u — внутренняя энергия, рассчитанная на единицу массы вещества;
В термодинамике различают два процесса, в которых подведенное тепло равно разности энтальпий:
— расширение при постоянном давлении;
— скорость процесса небольшая, поэтому изменением кинетической энергии можно пренебречь.
Изменение энтальпии от температуры для однофазного состояния вещества выражается удельной теплоёмкостью при постоянном давлении Ср:
Влияние давления выражается следующим образом
Для идеальных газов изменение энтальпии с изменением давления выражается как
Для реальных газов изменение энтальпии с изменением давления выражается, как известно через коэффициент сжимаемости z:
Внутренняя энергия идеального газа зависит только от температуры. Зависимость внутренней энергии реального газа от объёма и давления была выяснена Джоулем и Томсоном.
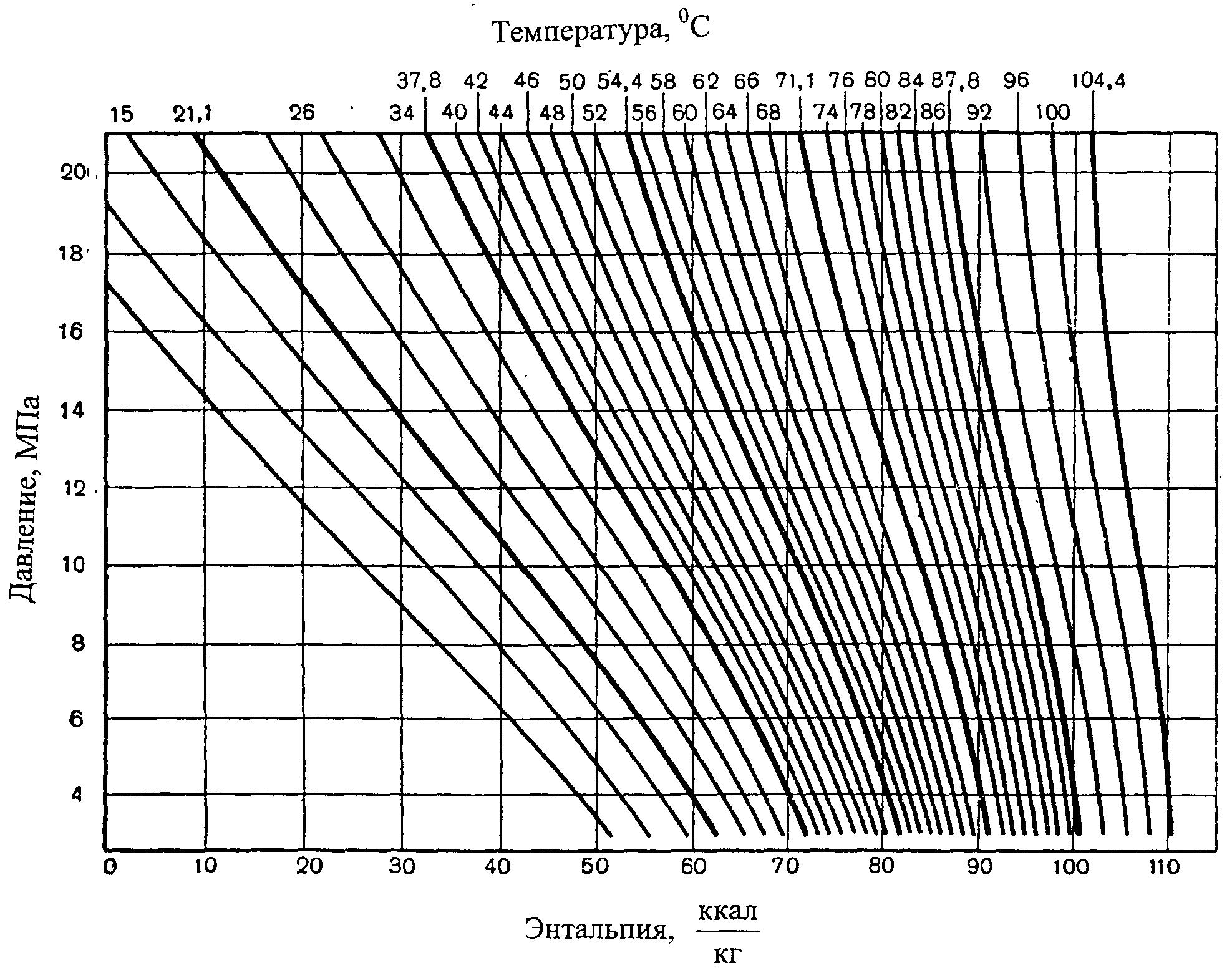
На рисунке 5 приведена графическая зависимость позволяющая оценивать влияние давления и температуры на энтальпию природного газа.
Рисунок 5 — Энтальпийная диаграмма природного газа
Эффект Джоуля – Томсона
Расширение газа при прохождении через так называемый дроссель – местное гидравлическое сопротивление (вентиль, кран, сужение трубопровода и т.п.), сопровождающееся изменением температуры носит название – дросселирование. Этот термодинамический процесс характеризуется постоянством энтальпии (Н = const).
Если во время расширения газа не совершается работа и не подводится и не отводится тепло, то этот процесс происходит при постоянной энтальпии. Однако изменение потенциальной энергии взаимодействия молекул реального газа с изменением расстояний между ними приводит к изменению кинетической энергии хаотического теплового движения молекул, т. е. к изменению температуры газа. Расширение газа без изменения количества теплоты происходит при постоянной энтальпии Н.
В частности, при движении флюидов через пористую среду из-за их адиабатического расширения и влияния дроссельного процесса возникают различного рода термические эффекты. Например, адиабатическое расширение флюидов ( жидкость, газ) сопровождающееся понижением температуры в меньшей степени оказывает влияние на температурные изменения в пласте и на забое работающей скважины ввиду большой теплоёмкости Ср горных пород, а дроссельный процесс вызывает значительные температурные изменения на забое работающей скважины.
Эффектом Джоуля — Томсона называется изменение температуры реального газа в процессе его расширения. При охлаждении газа эффект считается положительным, при нагревании его — отрицательным.
Изменение температуры при снижении давления на 0,1 МПа (1 кгс/см 2 ) называется коэффициентом Джоуля — Томсона. Этот коэффициент изменяется в широких пределах и может иметь положительный или отрицательный знак.
Различают дифференциальный и интегральный коэффициент Джоуля Томсона.
Дифференциальный эффект коэффициента Джоуля — Томсона, выражающийся через абсолютные параметры состояния газа
т. е. коэффициент Джоуля — Томсона равен частной производной от температуры по объёму при постоянной внутренней энергии.
Из уравнения (15) видно, что коэффициент Джоуля-Томсона состоит из двух слагаемых:
— охлаждение за счёт адиабатического расширения;
— нагревание вещества при движении за счёт сил трения.
Изменение температуры газа в процессе изоэнтальпийного расширения при значительном перепаде давления на дросселе называется интегральным дроссель эффектом. Это изменение определяется из соотношения следующего вида:
или из энтальпийных диаграмм.
Приближённо конечную температуру природного газа в процессе дросселирования можно рассчитать по выражению следующего вида
Для реальных газов коэффициент Джоуля Томсона получается из уравнения (14) и уравнения состояния
Как видно из уравнения (18) что если:
— отрицательно, то > 0 и газ при дросселировании нагревается;
=0 то = 0 и газ имеет инверсии и кривая точек инверсии соответствует линии поворота сетки графиков коэффициента сверхсжимаемости углеводородных газов (см. нижнюю часть линий на рис.2 , лекция 5).
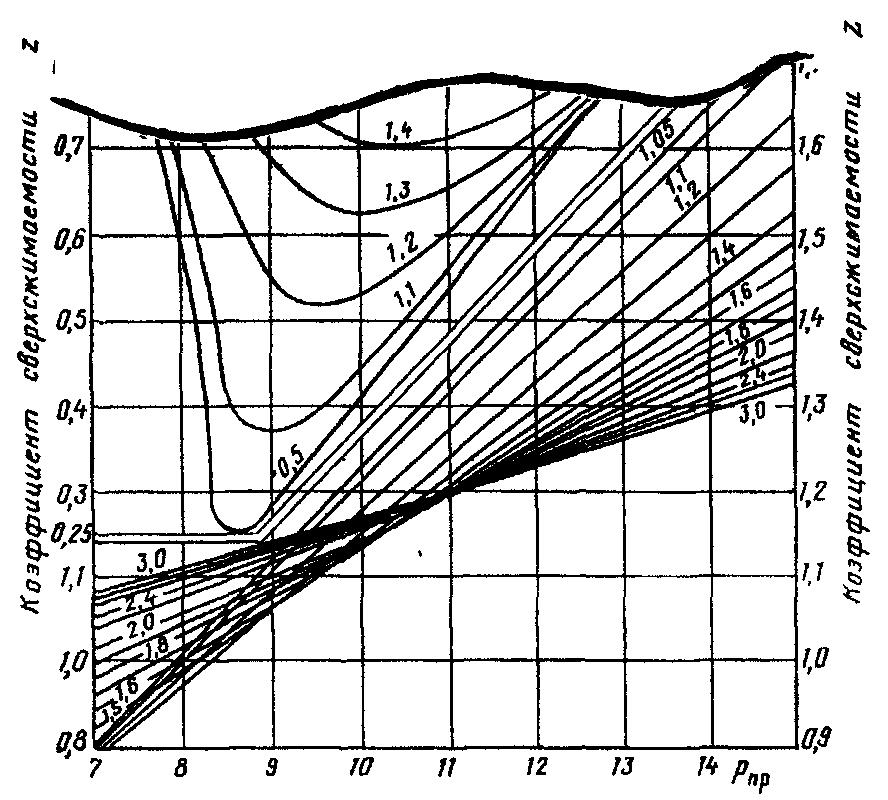
Фрагмент графической зависимости приведен на рисунке 6.
Рисунок 6 Фрагмент графической зависимости коэффициента сверхсжимаемости Z природных газов от приведенных давления и температуры.
Как видно из рисунка 6, значения температуры и давления инверсии высокие, что в большинстве случаев вызывает эффект охлаждения газа при его движении из пласта в скважину.
Следует заметить, что зависимость изменения температур от перепада давления для конкретного дроссельного процесса можно определить графическим способом из энтальпийной диаграммы (см. рис. 5).
Дифференциальные коэффициента Джоуля Томсона определяются при различных значениях давления Р как производные функции Т = f (Р) для данного значения давления и они обычно возрастают по мере падения давления.
Интегральный коэффициент Джоуля-Томсона для природного газа изменяется в пределах от 2 до 4 К/МПа в зависимости от состава газа, падения давления и начальной температуры газа. Для приближенных расчётов среднее значение коэффициента Джоуля — Томсона принимают равным 3 К/МПа. Для жидкостей справедливо следующее соотношение
и поэтому при дросселировании они нагреваются. Для наибольшего снижения температуры газа в штуцере необходимо производить удаление жидкости из газового потока до его поступления в штуцер. Интегральный коэффициент Джоуля – Томсона для нефти изменяется в пределах от 0,4 до 0,6 К/МПа а для воды он составляет 0,235 К/МПа.
Источник