- 13) Строение, номенклатура, стереоизомерия аминокислот.Классификация аминокислот: химические (по природе радикала и содержащихся в нём заместителей, по полярности радикалов) и биолгическая.
- 1.5. Α-Аминокислоты
- 1.5.1. Изомерия аминокислот
- 1.5.1.1. Изомерия положения аминогруппы
- 1.5.1.2. Оптическая изомерия аминокислот
- L-аминокислота d-аминокислота
- 1.2 Аминокислоты
- 1.2.1 Строение аминокислот
- 1.2.2 Оптическая активность аминокислот
- 1.2.3 Номенклатура
13) Строение, номенклатура, стереоизомерия аминокислот.Классификация аминокислот: химические (по природе радикала и содержащихся в нём заместителей, по полярности радикалов) и биолгическая.
Стереоизомерия. Принцип построения аминокислот, т. е. нахождение у одного и того же атома углерода двух различных функциональных групп, радикала и атома водорода, уже сам по себе предопределяет хиральность альфа-атома углерода. Исключение составляет простейшая аминокислота глицин Н2N-СН2-СООН, не имеющая углеводородного радикала R и соответственно центра хиральности. Относительная конфигурация аминокислот определяется как и у гидроксикислот по конфигурационному стандарту — глицериновому альдегиду — с использованием гидроксикислого ключа. Расположение в стандартной проекционной формуле Фишера аминогруппы слева (подобно ОН-группе в L-глицериновом альдегиде) ответствует L-конфигурации, справа — D-конфигурации хирального атома углерода. По R,S-системе обозначений углеродный атом у всех аминокислот L-ряда имеет S-, а у D-ряда — R-конфигурацию (исключение составляет цистеин).
Большинство аминокислот содержит в молекуле один асимметрический атом углерода и существует в виде двух оптически активных энантиомеров и одного оптически неактивного рацемата. Почти все природные аминокислоты принадлежат к L-ряду.
Изолейцин, треонин, 4—гидроксипролин — содержат в молекуле по два центра хиральности. Эти аминокислоты могут существовать в виде четырех диастереомеров, представляющих собой две пары энантиомеров, каждая из которых образует рацемат. Из этих четырех стереоизомеров для построения белков человеческого организма используется только один.
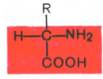
Все встречающиеся в природе аминокислоты обладают общим свойством – амфотерностью (от греч. amphoteros – двусторонний), т.е. каждая аминокислота содержит как минимум одну кислотную и одну основную группы. Общий тип строения α-аминокислот может быть представлен в следующем виде:
Как видно из общей формулы, аминокислоты будут отличаться друг от друга химической природой радикала R, представляющего группу атомов в молекуле аминокислоты, связанную с α-углеродным атомом и не участвующую в образовании пептидной связи при синтезе белка. Почти все α-амино- и α-карбоксильные группы участвуют в образовании пептидных связей белковой молекулы, теряя при этом свои специфические для свободных аминокислот кислотно-основные свойства. Поэтому все разнообразие особенностей структуры и функции белковых молекул связано с химической природой и физико-химическими свойствами радикалов аминокислот. Именно благодаря им белки наделены рядом уникальных функций, не свойственных другим биополимерам, и обладают химической индивидуальностью.
Классификация аминокислот разработана на основе химического строения радикалов, хотя были предложены и другие принципы. Различают ароматические и алифатические аминокислоты, а также аминокислоты, содержащие серу или гидроксильные группы. Часто классификация основана на природе заряда аминокислоты. Если радикал нейтральный (такие аминокислоты содержат только одну амино- и одну карбоксильную группы), то они называются нейтральными аминокислотами. Если аминокислота содержит избыток амино- или карбоксильных групп, то она называется соответственно основной или кислой аминокислотой.
Современная рациональная классификация аминокислот основана на полярности радикалов (R-групп), т.е. способности их к взаимодействию с водой при физиологических значениях рН (близких к рН 7,0). Различают 5 классов аминокислот, содержащих следующие радикалы: 1) неполярные (гидрофобные); 2) полярные (гидрофильные); 3) ароматические (большей частью неполярные); 4) отрицательно заряженные и 5) положительно заряженные. В представленной классификации аминокислот (табл. 1.3) приведены наименования, сокращенные английские и русские обозначения и однобуквенные символы аминокислот, принятые в отечественной и иностранной литературе, а также значения изоэлектрической точки (рI) и молекулярной массы (М). Отдельно даются структурные формулы всех 20 аминокислот белковой молекулы.
14) Кислотно-основные свойства альфа-аминокислот. Понятие об изоэлектрическом состоянии и изоэлектрической точке, электрофоретическом разделении аминокислот.Поясните на примере глицына, лизина, глутаминовой кислоты.
Источник
1.5. Α-Аминокислоты
Аминокислоты представляют собой основные «строительные» единицы всех белков.
Большинство аминокислот, участвующих в биохимических превращениях, являются карбоновыми кислотами, содержащими карбоксильную и аминную группы, которые находятся у одного и того же углеродного атома. В организме человека найдено 70 аминокислот. Двадцать из них входят в состав белков. Это так называемые протеиногенные аминокислоты.
Общая формула α-аминокислот представлена на Рис. 1.2:
Рис. 1.2. Общая формула аминокислот
Аминокислоты отличаются друг от друга структурой боковых групп, которые в приведенной выше формуле, обозначены через R. Эти группы имеют различную химическую структуру.
1.5.1. Изомерия аминокислот
1.5.1.1. Изомерия положения аминогруппы
Для аминокислот, прежде всего, характерна изомерия положения аминогруппы.
В биологии и химии до сих пор широко распространены названия аминокислот, в которых взаимное расположение аминогруппы по отношению к карбоксильной группе обозначается греческими буквами.
Так, если аминогруппа и карбоксил находятся у одного и того же атома углерода, то такая аминокислота называется α-аминокислотой.
В β-аминокислотах функциональные группа разделены двумя атомами углерода, в γ- — тремя и т.д.
Белки образованы только из α-аминокислот, но в организме встречаются и другие аминокислоты. Например γ-аминомасляная кислота (ГАМК):
Рис. 1.3. γ-аминомасляная кислота
ГАМК играет важную роль в механизме передачи нервного импульса.
1.5.1.2. Оптическая изомерия аминокислот
α-Аминокислоты характеризуются наличием оптической активности, т. е. они могут вращать плоскость поляризованного света вправо или влево. Это свойство природных аминокислот обусловлено наличием ассиметрического атома углерода или иначе: хирального центра (хиральность от греч. Cheir – рука), т. е. атома углерода с четырьмя различными заместителями.
Все α-аминокислоты, имеющие ассиметричесийй атом углерода, образуют оптические (зеркальные, т. е. которые нельзя совместить) изомеры.
Оптические изомеры принято обозначать латинскими буквами. L— (от лат. Louvus – левый) и D— (от лат dexter – правый).
L-аминокислота d-аминокислота
Рис. 1.4. L и D оптические изомеры α-аминокислот
Считают, что кислота относится к L-ряду, если в написании фишеровской проекции аминогруппа расположена слева (рис. 1.4).
Все природные аминокислоты, входящие в состав белков, относятся именно к L-ряду.
Вся белковая жизнь на земле – «левая». Есть и «исключения», но они только подтверждают правило. Оказывается, D-аминокислоты крайне редко, но все же встречаются в природе.
Например, они присутствуют в оболочке бактерии, которая является возбудителем сибирской язвы. Именно поэтому оболочка бактерии не разрушается ферментами, разрывающими белковые цепи L-аминокислот.
Из 20 α—аминокислот, входящих в состав белков:
1) 17 обладают одним ассиметричным атомом углерода;
2) одна не содержит ассиметричного атома углерода: глицин;
3) две имеют два ассиметричных атома углерода: изолейцин и треонин.
Источник
1.2 Аминокислоты
Органические соединения, содержащие в молекуле карбоксильную (– СООН) и аминогруппы (– HN), называются аминокислотами. В природе встречаются как в свободном виде, так и, главным образом, в составе пептидов, белков, ферментов.
Белки построены исключительно из -аминокислот, входящих в состав изученных белков. Природные аминокислоты получают гидролизом белков растительного и животного происхождения.
Аминокислоты делятся на заменимые и незаменимые. К незаменимым аминокислотам относятся те из них, которые не синтезируются в результате биохимических превращений в организме. Человек получает их с пищей. В их число входят следующие аминокислоты: валин, лейцин, изолейцин, лизин, метионин, треонин, фенилаланин и триптофан.
Аминокислоты используются как в качестве лекарственных веществ, так и в качестве добавок в пищевые продукты с целью повышения их биологической ценности.
Промышленный синтез аминокислот осуществляют микробиологическим методом.
1.2.1 Строение аминокислот
Хотя аминокислоты обычно изображают как соединения, содержащие амино- и карбоксильную группу формулой H2N – CHR – COOH, некоторые их свойства, как физические, так и химические, не согласуются с этой структурой:
- в противоположность аминам и карбоновым кислотам, аминокислоты – нелетучие кристаллические вещества с высокой температурой плавления;
- нерастворимы в неполярных растворителях и заметно растворимы в воде;
- в водных растворах имеют высокий дипольный момент;
- константы кислотности и основности для групп (– СООН) и (– NH) необычайно малы.
Все эти свойства вполне соответствуют структуре диполярного иона для аминокислот H3N + – CHR – COO – .
1.2.2 Оптическая активность аминокислот
За исключением аминокислоты глицина, все остальные -аминокислоты – оптически активные вещества, так как в их молекулах имеется асимметричный атом углерода. Аминокислоты, входящие в состав всех белков, а также, встречающиеся в живых организмах в свободном виде (природные аминокислоты), относятся к L – ряду.
Одни из этих аминокислот являются правовращающими, другие левовращающими. В оптические антиподы природных аминокислот L – ряда входят аминокислоты D – ряда. Эти аминокислоты получают путем синтеза, в природе же они встречаются редко. Они не входят в белок и очень редко встречаются в свободном состоянии в организмах.
Для ориентировки в оптических свойствах естественных аминокислот обычно к букве L добавляют знак «+» для обозначения правого вращения и знак «–» для левого вращения.
1.2.3 Номенклатура
Аминокислоты называют, обычно, как замещенные соответствующих карбоновых кислот, обозначая положение аминогруппы буквами греческого алфавита.
Применяется также систематическая номенклатура, а для простейших аминокислот – эмпирические названия.
Примеры: (названия приведены по технической, систематической и эмпирической номенклатурам, соответственно):
СН2(NН2) – СООН – -Аминоуксусная кислота; аминоэтановая кислота; глицин.
СН3 – CH(NН2) – СООН – -Аминопропионовая кислота; 2-аминопропановая кислота; аланин.
Источник