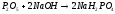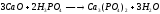Природные соединения и получение фосфора
По распространенности в земной коре фосфор опережает азот, серу и хлор. В отличие от азота фосфор, из-за большой химической активности встречается в природе только в виде соединений. Наиболее важные минералы фосфора — апатит Са5Х(РО4)3 (Х — фтор, реже хлор и гидрооксильная группа) и фосфорит основой
которого является Са3(РО4)2. Крупнейшее месторождение апатитов находится на Кольском полуострове, в районе Хибинских гор. Залежи фосфоритов находятся в районе гор Каратау, в Московской, Калужской, Брянской областях и в других местах. Фосфор входит в состав некоторых белковых веществ, содержащихся в генеративных органах растений, в нервных и костных тканях организмов животных и человека. Особенно богаты фосфором мозговые клетки.
В наши дни фосфор производят в электрических печах, восстанавливая апатит углем в присутствии кремнезема:
Ca3(PO4)2+3SiO2+5C3CaSiO3+5CO+P2.
Пары фосфора при этой температуре почти полностью состоят из молекул Р2, которые при охлаждении конденсируются в молекулы Р4.
Химические свойства
Электронная конфигурация атома фосфора
1S 2 2S 2 2P 6 3S 2 3P 3 3d 0
Наружный электронный слой содержит 5 электронов. Наличием трех неспаренных электронов на внешнем энергетическом уровне объясняет то, что в нормальном, невозбужденном состоянии валентность фосфора равна 3.
Но на третьем энергетическом уровне имеются вакантные ячейки d-орбиталей, поэтому при переходе в возбужденное состояние 3S-электроны будут разъединяться, переходить на d подуровень, что приводит к образованию 5-ти неспаренных элементов.
Таким образом, валентность фосфора в возбужденном состоянии равна 5.
В соединениях фосфор обычно проявляет степень окисления +5, реже +3, -3.
4P 0 + 5O2 2P2 +5 O5
(при недостатке кислорода: 4P 0 + 3O2 2P2 +3 O3)
2P 0 + 3Cl2 2P +3 Cl3
P 0 + 5S P2 +5 S5
(галогениды фосфора легко разлагаются водой, например:
PCl3 + 3H2O H3PO3 + 3HCl PCl5 + 4H2O H3PO4 + 5HCl)
3P 0 + 5HN +5 O3 + 2H2O 3H3P +5 O4 + 5N +2 O
4. С металлами образует фосфиды, в которых фосфор проявляет степень окисления — 3:
2P 0 + 3Mg Mg3P2 -3
(фосфид магния легко разлагается водой Mg3P2 + 6H2O 3Mg(OH)2 + 2PH3 (фосфин))
3Li + P Li3P -3
4P + 3NaOH + 3H2O PH3 + 3NaH2PO2
В реакциях (1,2,3) — фосфор выступает как восстановитель, в реакции (4) — как окислитель; реакция (5) — пример реакции диспропорционирования.
Фосфор может быть как восстановителем, так и окислителем.
Аллотропные изменения
В свободном состоянии фосфор образует несколько аллотропных видоизменений. Это объясняется тем, что атомы фосфора способны, взаимно соединяясь, образовывать кристаллические решетки различного типа.
Физические свойства фосфора
Внешний вид и характерные признаки
Белый кристаллический порошок, ядовит, самовозгорается на воздухе. При 280—300°С переходит в красный
Белый кристаллический порошок, ядовит, самовозгорается на воздухе. При 280—300°С переходит в красный
Красный кристаллический или аморфный порошок, неядовит. При 220°С и 12 10 8 Па переходит в черный фосфор. Загорается на воздухе только при поджигании
При нагревании переходит в красный фосфор
Графитоподобная структура. При нормальных условиях — полупроводник, под давлением проводит электрический ток как металл
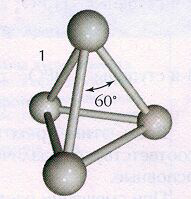
Белая модификация фосфора, получающаяся при конденсации паров, имеет молекулярную кристаллическую решетку, в узлах которой дислоцированы молекулы Р4 (рис.1). Из-за слабости межмолекулярных сил белый фосфор летуч, легкоплавок, режется ножом и растворяется в неполярных растворителях, например в сероуглероде. Белый фосфор весьма реакционноспособное вещество. Он энергично взаимодействует с кислородом, галогенами, серой и металлами. Окисление фосфора на воздухе сопровождается разогреванием и свечением. Поэтому белый фосфор хранят под водой, с которой он не реагирует. Белый фосфор очень токсичен.
Около 80% от всего производства белого фосфора идет на синтез чистой ортофосфорной кислоты. Она в свою очередь используется для получения полифосфатов натрия (их применяют для снижения жесткости питьевой воды) и пищевых фосфатов. Оставшаяся часть белого фосфора расходуется для создания дымообразующих веществ и зажигательных смесей.
Техника безопасности. В производстве фосфора и его соединений требуется соблюдение особых мер предосторожности, т.к. белый фосфор – сильный яд. Продолжительная работа в атмосфере белого фосфора может привести к заболеванию костных тканей, выпадению зубов, омертвению участков челюстей. Воспламеняясь, белый фосфор вызывает болезненные, долго не заживающие ожоги. Хранить белый фосфор следует под водой, в герметичных сосудах. Горящий фосфор тушат двуокисью углерода, раствором CuSO4 или песком. Обоженную кожу следует промыть раствором KmnO4 или CuSO4. Противоядием при отравлении фосфором является 2%-ый раствор CuSO4.
При длительном хранении, а также при нагревании белый фосфор переходит в красную модификацию (впервые его получили лишь 1847 году). Название красный фосфор относится сразу к нескольким модификациям, различающихся по плотности и окраске: она колеблется от оранжевой до темно-красной и даже фиолетовой. Все разновидности красного фосфора нерастворимы в органических растворителях, и по сравнению с белым фосфором они менее реакционноспособны и имеют полимерное строение: это тетраэдры Р4, связанные друг с другом в бесконечные цепи (рис.2).
Красный фосфор находит применение в металлургии, производстве полупроводниковых материалов и ламп накаливания, используется в спичечном производстве.
Наиболее стабильной модификацией фосфора является черный фосфор. Его получают аллотропным превращением белого фосфора при t=220 0 C и повышенным давлением. По внешнему виду он напоминает графит. Кристаллическая структура черного фосфора слоистая, состоящая из гофрированных слоев (рис.3). Черный фосфор – это наименее активная модификация фосфора. При нагревании без доступа воздуха он, как и красный, переходит в пар, из которого конденсируется в белый фосфор.
Оксид фосфора (V)
Фосфор образует несколько оксидов. Важнейшим из них является оксид фосфора (V) P4O10 (Рис.4). Часто его формулу пишут в упрощенном виде – P2O5. В структуре этого оксида сохраняется тетраэдрическое расположение атомов фосфора.
P2+5O5 Фосфорный ангидрид (оксид фосфора (V))
Белые кристаллы, t 0 пл.= 570 0 С, t 0 кип.= 600 0 C, = 2,7 г/см 3 . Имеет несколько модификаций. В парах состоит из молекул P4H10, очень гигроскопичен (используется как осушитель газов и жидкостей).
Все химические свойства кислотных оксидов: реагирует с водой, основными оксидами и щелочами
1) P2O5 + H2O 2HPO3 (метафосфорная кислота)
P2O5 + 2H2O H4P2O7 (пирофосфорная кислота)
P2O5 + 3H2O 2H3PO4 (ортофосфорная кислота)
2) P2O5 + 3BaO Ba3(PO4)2
В зависимости от избытка щелочи образует средние и кислые соли:
гидрофосфат натрия
дигидрофосфат натрия
Благодаря исключительной гигроскопичности оксид фосфора (V) используется в лабораторной и промышленной технике в качестве осушающего и дегидратирующего средства. По своему осушающему действию он превосходит все остальные вещества. От безводной хлорной кислоты отнимает химически связанную воду с образованием ее ангидрида:
Ортофосфорная кислота. Известно несколько кислот, содержащих фосфор. Важнейшая из них — ортофосфорная кислота Н3РО4 (Рис.5).
Безводная ортофосфорная кислота представляет собой светлые прозрачные кристаллы, при комнатной температуре расплывающиеся на воздухе. Температура плавления 42,35 0 С. С водой фосфорная кислота образует растворы любых концентраций.
Ортофосфорной кислоте соответствует следующая структурная формула:



В лаборатории ортофосфорную кислоту получают окислением фосфора 30%-ной азотной кислотой:
В промышленности ортофосфорную кислоту получают двумя способами: экстракционным и термическим.
1. В основе экстракционного метода лежит обработка измельченных природных фосфатов серной кислотой:
Ортофосфорная кислота затем отфильтровывается и концентрируется упариванием.
2. Термический метод состоит в восстановлении природных фосфатов до свободного фосфора с последующим его сжиганием до Р4О10 и растворением последнего в воде. Производимая по данному методу ортофосфорная кислота характеризуется более высокой чистотой и повышенной концентрацией (до 80% массовых).
Физические свойства. Ортофосфорная кислота — твердое, бесцветное, кристаллическое вещество, хорошо растворимое в воде.
Химические свойства ортофосфорной кислоты представлены в табл.2:
Химические свойства ортофосфорной кислоты
Общие с другими кислотами
1. Водный раствор кислоты изменяет окраску индикаторов. Диссоциация происходит ступенчато:
Легче всего идет диссоциация по первой ступени и труднее всего – по третьей
2. Реагирует с металлами, расположенными в вытеснительном ряду до водорода:
3. Реагирует с основными оксидами:
4. Реагирует с основаниями и аммиаком; если кислота взята в избытке, то образуются кислые соли:
5. Реагирует с солями слабых кислот:
Источник
Вопрос№51. Фосфор, его природные соединения (фосфориты и апатиты). Свойства фосфора, его аллотропические видоизменения. Биологическая роль фосфора.
Общее содержание фосфора в земной коре составляет 0,08%. В природе фосфор встречается только в виде соединений; важнейшее из них — фосфат кальция — минерал апатит. Известно много разновидностей апатита, из которых наиболее распространен фторапатит ЗСаз(РО4)2 * СаF2. Разновидности апатита слагают осадочные горные породы — фосфориты. Фосфор входит также в состав белковых веществ в виде различных соединений. Содержание фосфора в тканях мозга составляет 0,38%, в мышцах — 0,27%.
Самые богатые в мире залежи апатитов находятся близ г. Кирове на Кольском полуострове. Фосфориты широко распространены в России (на Урале, в Поволжье, Сибири), Казахстане, Эстонии, Беларуси, Северной Африке, Сирии, США и др. Фосфор необходим для жизни растений. Поэтому почва всегда должна содержать достаточное количество соединений фосфора.
Уменьшение неметалличности элемента фосфора по сравнению с азотом сказывается на свойствах его простых веществ. Так, фосфор, в отличие, от азота, имеет несколько аллотропных модификаций: белый, красный, черный и др.
Белый фосфор — бесцветное и очень ядовитое вещество. Получается конденсацией паров фосфора. Не растворяется в воде, но хорошо растворяется в сероуглероде. При длительном слабом нагревании белый фосфор переходит в красный.
Красный фосфор — порошок красно-бурого цвета, не ядовит. Нерастворим в воде и сероуглероде. Установлено, что красный фосфор представляет собой смесь нескольких аллотропных модификаций, которые отличаются друг от друга цветом (от алого до фиолетового) и некоторыми другими свойствами. Свойства красного фосфора во многом зависят от условий его получения.
Черный фосфор по внешнему виду похож на графит, жирный на ощупь, обладает полупроводниковыми свойствами. Получается длительным нагреванием белого фосфора при очень большом давлении (200 «С и 1200 МПа).
- Взаимодействие с простыми веществами
- Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
- с металлами — окислитель, образует фосфиды:
- с неметаллами — восстановитель:
- Взаимодействие с водой
- Взаимодействие со щелочами
- Восстановительные свойства
- Реакция окисления также происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
Источник